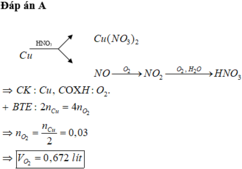
Hòa tan hoàn toàn m gam Fe3O4 vào dung dịch HNO3 loãng dư, tất cả lượng khí NO thu được được đem oxi hóa thành NO2 rồi sục vào nước cùng dòng khí O2 để chuyển hết thành HNO3. Cho biết thể tích oxi đã tham gia quá trình trên là 3,36 lít. Khối lượng m là:
A. 139,2
B. 13,92
C. 1,392
D. 1392







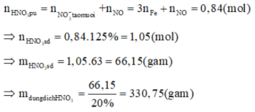
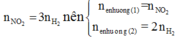

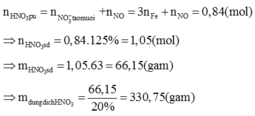
Đáp án A
Các phản ứng xảy ra:
3Fe3O4 + 28HNO3 g 9Fe(NO3)3 + NO + 14H2O
NO + O2 g NO2
2NO2 + O2 + H2O g2HNO3
Trong toàn bộ quá trình, chỉ có nguyên tố Fe và O thay đổi số oxi hóa (nguyên tố N không có sự thay đổi số oxi hóa). Do đó ta có các quá trình nhường và nhận electron như sau: