Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol A l 2 S O 4 3 và 0,1 mol H 2 S O 4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là
A. 0,45.
B. 0,15
C. 0,25.
D. 0,35.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
nAl(OH)3= 7 , 8 78 = 0 , 1
2NaOH + H2SO4 à Na2SO4 + 2H2O (1)
0,2 ß 0,1
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol.
6NaOH + Al2(SO4)3 à 3Na2SO4 + 2Al(OH)3 (2)
0,6 ß 0,1 à 0,2
NaOH + Al(OH)3 à NaAlO2 + 2H2O (3)
0,1 ß 0,1
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
è → Vdd NaOH = 0,9 : 2 = 0,45 M

Đáp án D
V có giá trị lớn nhất vậy có các phương trình

Vậy nNaOH = 0,9 ⇒ V = 0,45

Đáp án C
Bản chất phản ứng là :
Lượng NaOH dùng nhiều nhất để tạo ra 0,1 mol Al OH 3 khi xảy ra cả phản ứng (3). Suy ra dung dịch sau phản ứng có chứa các ion SO 4 2 - , Na + , Al OH 4 -
Trong đó :
n SO 4 2 - = n H 2 SO 4 + 3 n Al 2 so 4 3 = 0 , 4 mol
n Al OH 4 - = n Al 3 + - n Al OH 3 = 2 n Al 2 ( SO 4 ) 3 - n Al OH 3 = 0 , 1 mol
Áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có :
n NaOH = n Na + = n Al OH 4 - + 2 n SO 4 2 - = 0 , 9 mol
⇒ V dd NaOH 2 M = 0 , 45 lit

Đáp án C
Ta có :
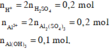
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị :

Dựa vào dạng hình học của đồ thị, ta thấy :
n Al ( OH ) 3 = 0 , 1 mol ⇒ n NaOH max = 0 , 9 mol ⇒ V dd NaOH 2 M = 0 , 9 2 = 0 , 45 lít

Ta có n Al3+ = 0,2 mol ; n H+ = 0,2 mol
Để NaOH dùng là lớn nhất khi xảy ra trường hợp tạo kết tủa,sau đó kết tủa tan
=> n NaOH = n H+ + 4nAl3+ - n Kết tủa = 0,9 mol
=> V = 0,9/2 = 0,45
=>B
Chọn đáp án A