Nung 16,8 gam hỗn hợp X gồm MgCO3 và CaCO3 đến khối lượng không đổi, rồi dẫn khí thu được vào 180 ml dung dịch Ba(OH)2 1M thì thu được 33,49 gam kết tủa. Thành phần % MgCO3 trong X là
A. 6,25% hoặc 31,25%.
B. 6,25% hoặc 68,75%.
C. 31,25% hoặc 93,75%.
D. 68,75% hoặc 93,75%.

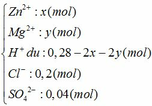

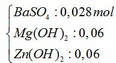



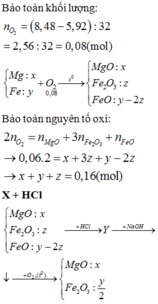
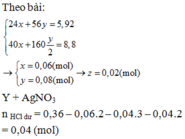
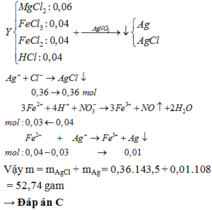


Đáp án B
• Nung 16,8 g CO2 + 0,18 Ba(OH)2 → 0,17 mol BaCO3↓
CO2 + 0,18 Ba(OH)2 → 0,17 mol BaCO3↓
• TH1: CO2 thiếu
CO2 + Ba(OH)2 → BaCO3↓ + H2O
nCO2 = nBaCO3 = 0,17 mol → nBaCO3 + nCaCO3 = a + b = 0,17
mMgCO3 + mCaCO3 = 84a + 100b = 16,8
→ a = 0,0125 mol; b = 0,1575 mol → mMgCO3 = 0,0125 × 84 = 1,05 gam
• TH2: CO2 dư
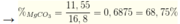
CO2 + Ba(OH)2 → BaCO3↓ + H2O (*)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (**)
Theo (*) nCO2 (*) = 0,18 mol; nBaCO3 = 0,17 mol
Theo (**) nBaCO3 (**) phản ứng = 0,18 - 0,17 = 0,01 mol → nCO2 (**) = 0,02 mol
→ ∑nCO2 = 0,18 + 0,01 = 0,19 mol
→ nBaCO3 + nCaCO3 = a + b = 0,19; mMgCO3 + mCaCO3 = 84a + 100b = 16,8
→ a = 0,1375 mol; b = 0,0525 mol → mMgCO3 = 11,55 gam