Theo Tổ chức Y tế Thế giới, nồng độ tối đa cho phép của ion Cd 2 + trong nước là 0,005 mg/l. Khi cho dung dịch H 2 S dư vào 500 ml một mẫu nước thấy có 0 , 288 . 10 - 3 gam kết tủa CdS. Phát biểu nào sau đây không đúng ?
A. Mẫu nước trên chưa bị ô nhiễm cađimi
B. Kết tủa CdS có màu vàng
C. Ion Cd 2 + thường có trong nước thải công nghiệp
D. Hàm lượng cađimi có trong mẫu nước là 4 . 10 - 6 M

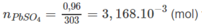

Đáp án A