Cho 0,05 mol halogen X 2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam muối. Nguyên tố halogen là
A. Br.
B. Cl.
C. F.
D. I.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

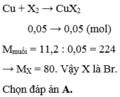

Theo đề, ta có: \(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTTH: \(X_2+Cu\rightarrow CuX_2\)
Số mol: 0,05 ----------> 0,05
Theo phương trình, có: \(n_{CuX_2}=n_{Cu}=0,05\left(mol\right)\)
Hay: \(\dfrac{11,2}{64+X.2}=0,05\Leftrightarrow X=80\)
Vậy X là Brom.
Chon (B)

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: \(Cu+X_2->CuX_2\)
Theo PT ta có: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
=> \(M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g/mol\right)\)
=> Ta có: \(64+2.X=224\)
\(\Leftrightarrow2X=160\Leftrightarrow X=80\left(Br\right)\)
Vậy nguyên tố halogen đó là Brom (Br)
X2 + Cu → CuX2
\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
\(\Rightarrow M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g\right)\)
\(\Leftrightarrow64+2M_X=224\)
\(\Leftrightarrow2M_X=160\)
\(\Leftrightarrow M_X=80\left(g\right)\)
Vậy X là nguyên tố Brom

Gọi halogen đó là X , CTTQ: CuX2
\(PTHH:Cu+X_2\underrightarrow{^{to}}CuX_2\)
Áp dụng ĐLTL ta có:
\(\Leftrightarrow\frac{22,4}{5,6}=\frac{64+2X}{33,75}\)
\(\Rightarrow x=35,5\left(Clo\right)\)
Vậy halogen là Clo ( Clo )