Một loại quặng sắt manhetit chứa 90% F e 3 O 4 . Tính khối lượng của Fe có trong 1 tấn quặng trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lường Fe3O4 có trong 1 tấn quặng là :
mFe3O4 = 1 x 90% = 0,9 ( tấn )
Khối lượng Fe trong Fe3O4 chiếm :
% Fe = 3 x 56 / ( 3x 56 + 4 x 16 ) = 72,41 %
Khối lượng Fe có trong 1 tấn quặng là :
mFe = 0,9 x 72,41%= 0,6517 ( tấn )
Khối lượng Fe3O4 trong 1 tấn quặng manhetit:
1: 100x90=0,9 (tấn)= 900 kg
\(\%m_{Fe}=\frac{3.M_{Fe}.100\%}{M_{Fe_3O_4}}=\frac{3.56.100}{232}\approx72,414\%\)
Khối lượng Fe:
900. 72,414%=651,726(kg)


a)
$m_{Fe_2O_3} = 1000.90\% = 900(kg)$
$n_{Fe_2O_3} = \dfrac{900}{160} = 5,625(kmol)$
$n_{Fe} = 2n_{Fe_2O_3} = 11,25(kmol)$
$m_{Fe} = 11,25.56 = 630(kg)$
b)
$n_{Fe} = \dfrac{1000}{56}(kmol)$
$n_{Fe_2O_3} = 0,5n_{Fe} = \dfrac{125}{14}(kmol)$
$m_{Fe_2O_3} = \dfrac{125}{14}.160 = \dfrac{10000}{7}(kg)$
$m_{quặng} = \dfrac{10000}{7} : 90\% = 1587,3(kg)$

a) Khối lượng Fe3O4 trong 1 tấn quặng sắt là:
mFe3O4 = 1.90% = 0,9 (tấn)
Phần trăm khối lượng Fe trong hợp chất Fe3O4 là:
%mFe = \(\dfrac{3.56}{3.56+4.16}\).100%= \(\dfrac{2100}{29}\)%
Khối lượng Fe có trong một tấn quặng là:
mFe = 0,9.\(\dfrac{2100}{29}\)% = 0,652 (tấn)

Gọi khối lượng mỗi quặng là a và b (tấn)
ta có: \(\frac{70a+40b}{a+b}=60\Leftrightarrow\frac{30a}{a+b}+40=60\Leftrightarrow30a=20\left(a+b\right)\Leftrightarrow10a=20b\Leftrightarrow a=2b\)
lại có\(\frac{70\left(a-8\right)+40\left(b-2\right)}{\left(a-8\right)+\left(b-2\right)}=58\Leftrightarrow\frac{30\left(a-8\right)}{a-8+b-2}+40=58\Leftrightarrow30\left(a-8\right)=18\left(a+b-10\right)\)
\(\Leftrightarrow30a-240=18a+18b-180\Leftrightarrow12a-18b=60\)
thay a=2b vào phương trình trên ta có
\(12\times2b-18b=60\Leftrightarrow24b-18b=60\Leftrightarrow6b=60\Leftrightarrow b=10\Rightarrow a=20\)
Vậy khối lượng quặng 1 là 20 tấn, khối lượng quặng 2 là 10 tấn
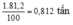
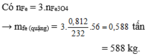

Đổi 1 tấn = 1000 kg
nFe2O3 = 1000 . 90% : 160 = 5,625 (kmol)
nFe = 5,625 . 3 = 16,875 (kmol)
mFe = 16,875 . 945 (kg)