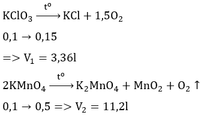1. phản ứng thế, phản ứng hóa hợp, phản ứng phân hủy là gì? viết phương trình hóa học minh họa?
2. a/ Nhiệt phân hoàn toàn 47,4 g KMnO4 ở nhiệt độ cao. Tính khối lượng chất rắn sau phản ứng?
b/ đốt cháy 8,96 lít khí hidro trong lượng Oxi trên. Sau phản ứng chất nào còn dư? Tính thể tích lượng chất dư?
3. a/ Nhiệt phân hoàn toàn 63,2 g KMnO4. Tính thể tích khí oxi thu được (đktc).
b/ dùng 4,48 lít khí hidro khử 24 gam đồng (II) oxit ở nhiệt độ cao. chất nào dư? dư bao nhiêu gam?
4. Đốt cháy hoàn toàn 41,1 gam kim loại hóa trị II cần dùng hết 3,36 lít khí O2. Xác định tên kim loại và khối lượng oxit sau phản ứng
5. Đốt cháy hoàn toàn 7,2 g Mg trong khí oxi thu được MgO.
a/ tính thể tích khí oxi cần dùng (đktc)
b/ tính số gam KClO3 cần dùng để điều chế lượng Oxi trên
6. Cho bột than dư vào hỗn hợp Fe2O3 và CuO đun nóng để phản ứng xảy ra hoàn toàn thu được 2g hỗn hợp kim loại và 2,24 lít khí (đktc). tính khối lượng hỗn hợp oxit ban đầu
7. cho khí hidro dư qua hỗn hợp Fe2O3, CuO đun nóng để phản ứng xảy ra hoàn toàn thu được 8,8g kim loại trong đó có 3,2 g hỗn hợp kim loại màu đỏ:
a/ tính khối lượng hỗn hợp oxit ban đầu
b/ thể tích khí oxi đã dùng
8. a/ viết phương trình hóa học xảy ra khi cho nước tác dụng với Na, K2O, SO3, CaO
b/ Hòa tan kim loại Natri vào nước, sau phản ứng thu được 4,48 lít khí hidro (đktc). tính khối lượng Natri cần dùng và khối lượng NaOH sau phản ứng
9. cho 4g S cháy trong 2,24 lít O2, sau phản ứng S có cháy hết? chất nào dư? Tính lượng dư ?Tính thể tích khí sau phản ứng?
10. cho hoàn toàn toàn hỗn hợp kim loại gồm Fe và Cu trong dung dịch HCl dư thu được 6,72l khí Hidro và 6,4 g chất rắn không tan
a/ tính lượng hỗn hợp ban đầu
b/ tính khối lượng mỗi kim loại và % khối lượng mỗi kim loại trong hỗn hợp đầu
11. Một hỗn hợp gồm CuO và Fe2O3 nặng 10 gam. Trong hỗn hợp này thì CuO chiếm 40% khối lượng. Dùng khí H2 để khử hoàn toàn hỗn hợp trên. Hãy tính:
a) Thể tích H2 (đktc) đã dùng?
b) Khối lượng hỗn hợp kim loại thu được?
12. oxi hóa 7,8 g kim loại hóa trị I, sau phản ứng thu được 9,4 gam oxit. Tìm tên kim loại, viết công thức hóa học và gọi tên oxit. tính thể tích không khí cần dùng (đktc)
mọi người giúp mình giải gấp giùm mốt mình thi rồi. cảm ơn nhiều ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$2KClO_3 \xrightarrow{t^o,MnO_2} 2KCl + 3O_2$
Phản ứng ứng trên thuộc phản ứng phân hủy vì có 1 chất tham giá phản ứng tạo thành hai hay nhiều chất mới tạo thành
b)
n KClO3 = 12,25/122,5 = 0,1(mol)
Theo PTHH : n O2 = 3/2 n KClO3 = 0,15(mol)
n P = 6,2/31 = 0,2(mol)
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
n P / 4 = 0,05 > n O2 / 5 = 0,0,03 => P dư sau phản ứng
n P pư = 4/5 n O2 = 0,12(mol)
n P2O5 = 2/5 n O2 = 0,06(mol)
Suy ra:
m P dư = 6,2 - 0,12.31 = 2,48 gam
m P2O5 = 0,06.142 = 8,52 gam
Ta có: \(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
a, PT: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)
_______0,1_______________0,15 (mol)
_ Pư phân hủy vì từ 1 chất ban đầu tạo ra 2 hay nhiều chất.
b, Ta có: VO2 = 0,15.22,4 = 3,36 (l)
c, Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Xét tỉ lệ: \(\dfrac{0,2}{4}>\dfrac{0,15}{5}\), ta được P dư.
Theo PT: \(\left\{{}\begin{matrix}n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,06\left(mol\right)\\n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{P\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{P_2O_5}=0,06.142=8,52\left(g\right)\\m_{P\left(dư\right)}=0,08.31=2,48\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,3\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,3.160=48\left(g\right)\)
c, \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,9\left(mol\right)\Rightarrow V_{H_2}=0,9.22,4=20,16\left(l\right)\)

\(a) P_2O_5 + 3H_2O \to 2H_3PO4 \\ b) 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2 \\ c) S + O_2 \xrightarrow{t^o} SO_2\\ d) 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ e) Mg + 2HCl \to MgCl_2 + H_2\\ f) Fe + H_2SO_4 \to FeSO_4 + H_2\\ g) BaO + H_2O \to Ba(OH)_2\)
Phản ứng phân hủy : b,d
Phản ứng thế: e,f

\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+H_2SO_4\left(l\right)\rightarrow FeSO_4+H_2\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)

a.b.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,2 0,1 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,1.22,4=2,24l\)
c.\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,05.232=11,6g\)

\(a)n_{KMnO_4} = a; n_{KClO_3} = b\Rightarrow 158a + 122,5b = 99,95(1)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = 0,5a +1,5b = \dfrac{14,56}{22,4}=0,65(2)\\ (1)(2)\Rightarrow a = 0,4 ; b = 0,3\\ \%m_{KMnO_4} = \dfrac{0,4.158}{99,95}.100\% = 63,23\%\\ \%m_{KClO_3} = 100\%-63,23\% = 36,77\%\)
\(n_{K_2MnO_4} = n_{MnO_2} = 0,5a = 0,2(mol)\\ n_{KClO_3} = b = 0,3(mol)\\ m_{hh\ sau\ pư} = 99,95 - 0,65.32 = 79,15(gam)\\ \%m_{K_2MnO_4} = \dfrac{0,2.197}{79,15}.100\% = 49,78\%\\ \%m_{MnO_2} = \dfrac{0,2.87}{79,15},100\% = 21,98\%\\ \%m_{KCl} = 28,24\%\)

\(n_{KMnO4} = \dfrac{15,8}{158} = 0,1 (mol) \\ PTHH: 2KMnO_4 \rightarrow (t^o) K_2MnO_4 + MnO_2 + O_2 \\ Mol: 0,1 \rightarrow 0,05 \rightarrow 0,05 \rightarrow 0,05 \\ 3Fe + 2O_2 \rightarrow (t^o) Fe_3O_4 \\ Mol:0,075 \leftarrow0,05 \leftarrow 0,025 \\ m_{Fe_3O_4} = 232 . 0,025 = 5,8(g)\)