Khi cho 2,00 gam hỗn hợp X gồm Mg, Al, Zn và Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thì
thu được 1,12 lít khí H 2 . Nếu cho 2,00 gam hỗn hợp X như trên phản ứng hoàn toàn với lượng dư khí Cl 2 thì thu
được 5,763 gam hỗn hợp muối. Tính % khối lượng của Fe có trong hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

• X gồm CH6O3N2 và C3H12O3N2 + NaOH dư → Y (3 khí) + dung dịch Z.
Z + HCl dư → khí thoát ra
CTCT 2 chất trong X là CH3NH3NO3 và (CH3NH3)2CO3.
• Phương trình phản ứng:
CH3NH3NO3 + NaOH → CH3NH2↑ + NaNO3 + H20
NH4OCOONH3CH2CH3 + 2NaOH → CH3CH2NH2↑ + NH3↑ + Na2CO3 + 2H2O
HCl + Z:
Na2CO3 + 2HCl → NaCl + H2O + CO2↑


Giải thích: Đáp án B
Số mol H2 là 0,05 mol
PTHH: Fe + 2HCl → FeCl2 +H2
Suy ra nFe = 0,05 mol → mFe = 2,8 → %Fe = 56%
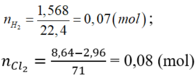
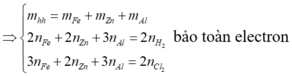
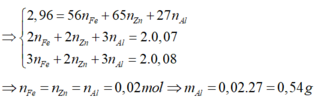





có nH2 = 1,12/22,4 = 0,05 mol
Áp dụng ĐLBT nguyên tố với H :
có nHCl = 2nH2 = 0,05.2 =0,1 mol
Áp dụng ĐLBT khối lượng , có :
mKL + mHCl = m muối + mH2
➜ m muối = 2 + 0,1.36,5 - 0,05.2 = 5,55 gam
có mCl-thêm vào= mmuối(TN2)-mmuối(TN2)=5,763-5,55 = 0,213 gam
⇒ nCl-thêm vào = 0,213/35,5 = 0,006 mol
PTHH :
FeCl2 + Cl- → FeCl3
0,006 0,006 (mol)
⇒ nFeCl2= nCl =0,006 mol
BTNT với Fe , có nFe = nFeCl2 = 0,006 mol
⇒ %mFe = \(\frac{0,006.56}{2}\) .100% = 16,8%