Oxi hóa chậm m gam Fe ngoài không khí sau một thời gian thu được 12 gam hỗn hợp X ( Fe , FeO , Fe2O3,Fe3O4 ). Để hòa tan hết X , cần vừa đủ 300 ml dung dịch HCl 1M , đồng thời giải phóng 0,672 lít khí ( đktc ). Tính m ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


m=10,08 gam
Giải thích các bước giải:
Sơ đồ phản ứng:
X+HCl→muối+H2+H2O
Ta có: nHCl=0,3.1=0,3 mol; nH2=0,67222,4=0,03 mol
Bảo toàn nguyên tố H:
nHCl=2nH2+2nH2O→nH2O=0,3−0,03.22=0,12 mol
Bảo toàn O:
Sơ đồ phản ứng:
\(X+HCl\rightarrow muoi+H_2+H_2O\)
Ta có:
\(n_{HCl}=0,3.1=0,3\left(mol\right)\)
\(n_{H2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
Bảo toàn nguyên tố H:
\(n_{HCl}=2n_{H2}+2n_{H2O}\Rightarrow n_{H2O}=\frac{0,3-0,03.2}{2}=0,12\left(mol\right)\)
Bảo toàn O:
\(n_{O.trong.X}=n_{H2O}=0,12\left(mol\right)\)
\(\Rightarrow m_{Fe.trong,X}=m=m_X-m_O=12-0,12.16=10,08\left(g\right)\)

$n_{H_2SO_4} = 0,18(mol) \Rightarrow n_{H^+} = 0,18.2 = 0,36(mol)$
$n_{H_2} = \dfrac{0,336}{22,4} = 0,015(mol)$
$2H^+ + O^{2-} \to H_2O$
$2H^+ + 2e \to H_2$
Ta có :
$n_{H^+} = 2n_O + 2n_{H_2} \Rightarrow n_O = \dfrac{0,36 - 0,015.2}{2} = 0,165(mol)$
$\Rightarrow m = m_X - m_O = 11,04 - 0,165.16 = 8,4(gam)$

Qui hỗn hợp về dạng : x mol Fe ; y mol FeO ; z mol Fe2O3
=> mhh = 56x + 72y + 160z = 26 (1)
Có nHCl = 2x + 2y + 6z = 0,91 mol (2)
Và nH2 = nFe = x = 0,195 mol (3)
Từ (1) ; (2) ; (3) => y = z = 0,065 mol
=> Khi nung kết tủa thì sản phẩm chỉ còn Fe2O3
Bảo toàn Fe : nFe2O3 = ½ nFe(hh đầu) = ½ . ( x + y + 2z) = 0,195 mol
=>m = 31,2g
=>B
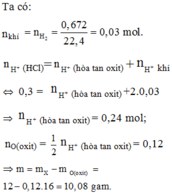
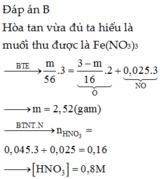
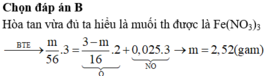
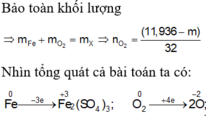
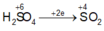
\(n_{khí}=n_{H2}=\frac{0,672}{22,4}=0.03mol\)
ta có :
\(n_{H+\left(HCL\right)}=n_{H+\left(hoàtanoxit\right)}+n_{H+\left(khí\right)}\)
=> 0,3 = \(n_{H+\left(hoàtanoxit\right)+}2.0,03\)
=> \(n_{H+\left(hoàtanoxit\right)}=0,24mol\\ n_{O\left(oxit\right)}=\frac{1}{2}n_{H+\left(hoàtanoxit\right)}=0,2mol\)
=> \(m=m_x-m_{o\left(oxit\right)}=12-0,12.16=10,08g\)
Sơ đồ phản ứng:
\(X+HCl\rightarrow muoi+H_2+H_2O\)
Ta có:
\(n_{HCl}=0,3.1=0,3\left(mol\right)\)
\(n_{H2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
Bảo toàn nguyên tố H:
\(n_{HCl}=2n_{H2}+2n_{H2O}\Rightarrow n_{H2O}=\frac{0,3-0,03.2}{2}=0,12\left(mol\right)\)
Bảo toàn O:
\(n_{O.trong.X}=n_{H2O}=0,12\left(mol\right)\)
\(\Rightarrow m_{Fe.trong.X}=m=m_X=m_O=12-0,12.16=10,08\left(g\right)\)