Cho 6g hỗn hợp gồm metan và etilen, chiếm thể tích 6,72 lít ở đktc.
a) Tính thành phần phần trăm các chất trong hỗn hợp theo số mol và theo khối lượng.
b) Khi dẫn 13,44 lít khí hỗn hợp đi qua dd nước brom, nhận thấy dd bị nhạt màu và bình chứa dd tăng thêm m(g) tính m?
Giúp mk vs mọi người môn hóa :))

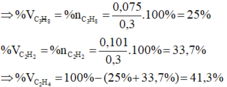
Trả lời:
a) Đặt số mol các chất trong hỗn hợp là CH4:amol;C2H4:bmolCH4:amol;C2H4:bmol
mCH4 + mC2H4 = 6 ⇒ 16a + 28b =6(I) nCH4+ nC2H4= 6,7222,4 ⇒ a + b = 0,3 (II)Từ(I),(II)⇒a=0,2mol;b=0,1molmCH4+mC2H4=6⇒16a+28b=6(I)nCH4+nC2H4=6,7222,4⇒a+b=0,3(II)Từ(I),(II)⇒a=0,2mol;b=0,1mol
Phần trăm thể tích mỗi chất trong hỗn hợp là:
%VCH4=%nCH4=nCH4nhh.100=0,20,3.100=66,67%⇒%VC2H4=100−66,67=33,33%%VCH4=%nCH4=nCH4nhh.100=0,20,3.100=66,67%⇒%VC2H4=100−66,67=33,33%
Phần trăm khối lượng mỗi chất trong hỗn hợp là:
%mCH4=mCH4mhh.100=16.0,26.100=53,33%⇒%mC2H4=100−53,33=46,67%%mCH4=mCH4mhh.100=16.0,26.100=53,33%⇒%mC2H4=100−53,33=46,67%
b)13,446,72=2b)13,446,72=2
⇒⇒ Số mol các chất trong 13,44 lít hỗn hợp khí là:
nCH4=2.0,2=0,4molnC2H4=2.0,1=0,2molnCH4=2.0,2=0,4molnC2H4=2.0,1=0,2mol
CH4 không bị dung dịch brom hấp thụ, C2H4 bị dung dịch brom hấp thụ theo phương trình sau:
CH2=CH2+Br2→BrCH2−CH2BrCH2=CH2+Br2→BrCH2−CH2Br
Dung dịch brom bị nhạt màu, chứng tỏ brom vẫn còn dư ⇒C2H4⇒C2H4 hết
Khối lượng bình brom tăng chính là khối lượng C2H4:C2H4:
m=mC2H4=28.0,2=5,6gam
~Học tốt!~
Mk ko biết dùng công thức nên hơi khó nhìn bạn chịu khó nhé!!! ^-^