Hòa tan hết m(g) X gồm: Na; \(K_2O;Ba;BaO\left(O\text{ chiếm }10\%\text{ khối lượng }\right)\) vào nước thu được 300 ml dung dịch Y và 0,336 (l) H2 (đktc) . Cho 300 ml dd Y tác dụng 200 ml dd gồm HCl 0,2 M và HNO3 0,3M thu được 500 ml dung dịch có pH=13. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Coi hh X gồm: Na, Ca và O.
Gọi: \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_{Ca}=b\left(mol\right)\\n_O=c\left(mol\right)\end{matrix}\right.\) ⇒ 23a + 40b + 16c = 20,52 (1)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo ĐLBT e, có: nNa + 2nCa - 2nO = 2nH2 ⇒ a + 2b - 2c = 0,1.2 (2)
Mà: \(n_{NaOH}=\dfrac{11,2}{40}=0,28\left(mol\right)\)
BTNT Na, có: a = nNa = nNaOH = 0,28 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}a=0,28\left(mol\right)\\b=0,24\left(mol\right)\\c=0,28\left(mol\right)\end{matrix}\right.\)
BTNT Ca, có: nCa(OH)2 = nCa = 0,24 (mol)
⇒ m = mCa(OH)2 = 0,24.74 = 17,76 (g)

Giải thích:
nO = 5,14%. 9,344:100% : 16 = 0,03 (mol) => nZnO = 0,03 (mol)
nH2 = 0,064 (mol) => nOH- = 2nH2 = 0,128 (mol)
ZnO + 2OH- → ZnO22- + H2O
0,03 → 0,06 → 0,03 (mol)
=> nOH- dư = 0,068 (mol)
Vậy dd Y gồm: nOH- dư = 0,068 (mol) và ZnO22- : 0,03 (mol)
Vì nH+ = 0,176 > nOH- + 2nZnO2 2- => Tạo kết tủa Zn(OH)2 sau đó kết tủa sẽ tan 1 phần.
H+ + OH- → H2O
0,068 ← 0,068
2H+ + ZnO22- → Zn(OH)2
0,06 ← 0,03→ 0,03
2H+ + Zn(OH)2 → Zn2+ + 2H2O
0,048→ 0,024
nZn(OH)2 còn lại = 0,03 – 0,024 = 0,006 (mol) => mZn(OH)2 = 0,594(g)
Đáp án D

Đáp án D
Do VH2 thu được ở 2 thí nghiệm khác nhau
⇒ Al dư ở thí nghiệm 1.
Đặt nNa = x; nAl = y.
● Xét thí nghiệm 1: Na → NaOH → NaAlO2.
⇒ nAl phản ứng = nNa = x.
Bảo toàn electron:
x + 3x = 2 × 0,4 ⇒ x = 0,2 mol.
● Xét thí nghiệm 2: Do NaOH dư
⇒ Al tan hết. Bảo toàn electron:
x + 3y = 2 × 0,55 ⇒ y = 0,3 mol.
||► m = 0,2 × 23 + 0,3 × 27 = 12,7(g).

Chọn đáp án D
Do VH2 thu được ở 2 thí nghiệm khác nhau ⇒ Al dư ở thí nghiệm 1.
Đặt nNa = x; nAl = y. ● Xét thí nghiệm 1: Na → NaOH → NaAlO2.
⇒ nAl phản ứng = nNa = x. Bảo toàn electron: x + 3x = 2 × 0,4 ⇒ x = 0,2 mol.
● Xét thí nghiệm 2: Do NaOH dư ⇒ Al tan hết. Bảo toàn electron:
x + 3y = 2 × 0,55 ⇒ y = 0,3 mol. ||► m = 0,2 × 23 + 0,3 × 27 = 12,7(g)

Đáp án D
Nhận thấy khi cho vào nước lượng H2 nhỏ hơn khi cho vào NaOH. Do vậy khi cho X vào nước thì Al dư.
Gọi số mol Na là x, Al là y.
Khi cho X vào nước, Al dư nên số mol Al phản ứng bằng số mol Na x+x.3 = 0,4.2
Cho X vào NaOH thì cả 2 phản ứng hết → x+3y=0,55.2
Giải được: x = 0,2; y = 0,3 → m = 12,7 gam

\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
Ta có: \(n_{Na}=2n_{H_2}=0,2\left(mol\right)\Rightarrow m=0,2.23=4,6\left(g\right)\)
\(n_{NaOH}=2n_{H_2}=0,2\left(mol\right)\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
\(C\%_{NaOH}=\dfrac{8}{4,6+75,6-0,1.2}.100=10\%\)

Đáp án C
Khi cho X vào H2O thì thu được 0,4 mol H2 còn khi cho vào NaOH thì thu được 0,55 mol H2 chứng tỏ khi cho vào H2O thì NaOH dư.
Gọi số mol Na và Al lần lượt là a, b
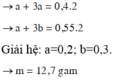

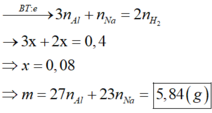
- Xét phản ứng giữa OH- và H+:
pH = 13 > 7 → Bazo còn dư
→ pOH = 14 - 13 = 1 → [OH-] = 0,1 M
→ nOH- dư = 0,1.0,5 = 0,05 mol
nH+ = nHCl + nHNO3 = 0,04 + 0,06 = 0,1 mol
PT ion: H+ + OH- → H2O
Bđ:___0,1___x
Pư:___0,1___0,1
Sau:___0___x-0,1
→ nOH- dư = x - 0,1 = 0,05 → x = 0,15 mol
- Xét phản ứng của X với H2O dư:
2X + 2nH2O → 2X(OH)n + nH2 → nOH- = 2nH2
X2On + nH2O → 2X(OH)n → nOH- = 2nO
Vậy nOH- = 2nH2 + 2nO → 0,15 = 2.0,015 + 2.nO
→ nO = 0,06
→ mO = 0,06.16 = 0,96 gam
Do O chiếm 10% hỗn hợp → m = 9,6 gam