Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi nAl = x (mol) => nNa = 2x (mol)
nH2 = 4,48 :22,4 = 0,2 (mol)
Na+ H2O → NaOH + 0,5H2↑
2x →x (mol)
Al + NaOH + H2O → NaAlO2 + 1,5H2↑
x → 1,5x (mol)
Vì Na : Al có tỉ lệ 1: 2 nên cả Na và Al cùng phản ứng hết
=> nH2 = x + 1,5x = 0,2
=> x = 0,08 (mol)
=> m = 0,08.27 + 2.0,08.23 = 5,84 (g)
Đáp án A

Đáp án D
Do VH2 thu được ở 2 thí nghiệm khác nhau
⇒ Al dư ở thí nghiệm 1.
Đặt nNa = x; nAl = y.
● Xét thí nghiệm 1: Na → NaOH → NaAlO2.
⇒ nAl phản ứng = nNa = x.
Bảo toàn electron:
x + 3x = 2 × 0,4 ⇒ x = 0,2 mol.
● Xét thí nghiệm 2: Do NaOH dư
⇒ Al tan hết. Bảo toàn electron:
x + 3y = 2 × 0,55 ⇒ y = 0,3 mol.
||► m = 0,2 × 23 + 0,3 × 27 = 12,7(g).

Chọn C
Gọi số mol Na, Al và Fe có trong m gam G lần lượt là x, y và z (mol)
Do khi cho G vào nước thu được số mol khí ít hơn khi cho G vào NaOH dư nên khi cho G vào nước dư chỉ có Na phản ứng hết.


Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D

Chọn D
Gọi số mol Na là x mol → số mol Al là 2x mol. Theo bài ra chất rắn không tan sau phản ứng là Al dư.


Giải thích:
nH2(1) = 8,96 : 22,4 = 0,4 (mol)
nH2(2) = 12,32 : 22,4 = 0,55 (mol)
Gọi mol nNa = x (mol); nAl = y (mol)
Bảo toàn e:
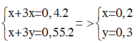
m = 0,2.23 + 0,3. 27 = 12,7(gam)
Đáp án D


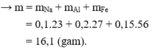
Đáp án B
= 5,84 gam