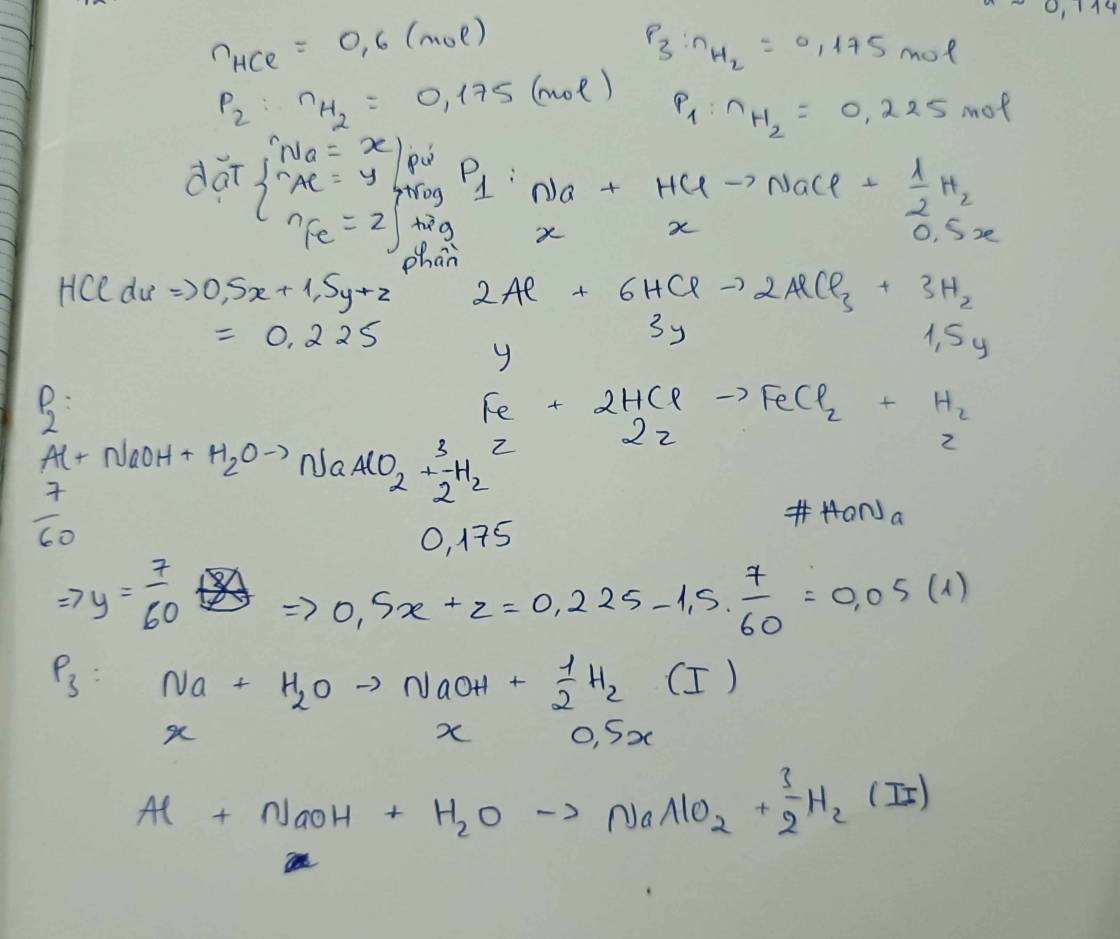Hỗn hợp Y gồm 3 kim loại Na, Al, Fe được nghiền nhỏ trộn đều và chia thành 3 phần bằng nhau. Hoà tan phần 1 trong 0,5lit dd HCl 1,2M được 5,04lít khí và dd A. Phần 2 cho tác dụng với dd NaOH dư thu được 3,92l khí. Phần 3 cho tác dụng với nước dư thu được 2,24lit khí. Biết thể tích các khí đo ở dktc và thể tích dung dịch không đổi.
1, khối lượng Na, Al trong Y là
2,nồng độ mol/l của HCl trong dung dịch A?
3,khối lượng chát tan trong dung dịch A