Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn

Đáp án A.
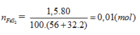
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
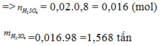

a) 4 FeS2 + 11 O2 -to-> 2 Fe2O3 + 8 SO2
SO2+ 1/2 O2 -to,xt-> SO3
SO3+ H2O -> H2SO4
mFeS2= 0,58. 3=1,74(tấn)
m(H2SO4, lí thuyết)=(98.1,74)/480=0,35525(tấn)
Vì: H=70% -> mH2SO4(TT)=0,35525.70%=0,248675(tấn)
=> mddH2SO4= (0,248675.100)/98=0,25375(tấn)=253,75(kg)

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)
Bạn đăng câu hỏi lần lượt lên nhé .
Bài 1:
a) Từ 100kg quặng pirit sắt (có 25% tạp chất ) có thể điều chế được bao nhiêu kg H2SO4 98% (Hiệu suất của cả quá trình là 60%)
b) Tình khối lượng H2SO4 70% cần dùng để điều chế được 468kg supephôtphat kép. Hiệu suất của cả quá trình là 80%.
Bài 2:
Hòa tan m(g) kim loại R có hóa trị II vào dung dịch HCl thu được dung dịch A. Đề trung hết lượng axit dư trong dung dịch A cần 64g dung dịch NaOH 12,5%. Phản ứng làm tạo thành dung dịch B chứa 4,68% NaCl và 13,3% RCl2. Cho tiếp lượng dư NaOH vào dung dịch B rồi lọc lấy kết tủa, đem nung nóng đến khối lượng không đổi được 14g chất rắn.
a) Xác định tên kim loại R và C% của dung dịch HCl đă dùng. Tính m.
b) Hòa tan hỗn hợp gồm m (g) R và p (g) RCO3 bằng H2SO4 loăng đư được hỗn hợp khí D có tỉ khối so với H2 là 8,636. Tính p.
Bài 3:
Cho 0,04 mol hỗn hợp A có FeO và Fe2O3 tác dụng với một lượng CO ở nhiệt độ cao. Sau một thời gian phản ứng thu được 4,784g hỗn hợp chất B có 4 chất. Khí sao phản ứng được hấp thụ vào dung dịch Ba(OH)2 dư thu được 9,062g kết tủa. Hòa tan B bằng dung dịch HCl dư, thu được 0,6272 lít H2.
a) Tính % về số mol các oxit trong A.
b) Tính % về khối lương các oxit tring hỗn hợp B (Biết rằng trong B có số mol Fe2O3 bằng 1/3 số mol FeO và Fe2O3).