Cho 8g lưu huỳnh trioxit tác dụng với nước thu được 250 ml dung dịch axit .Tính nồng độ mol của dung dịch axit thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M

Bài 1 :
\(n_{SO3}=\dfrac{8}{80}=0,1\left(mol\right)\)
a) Pt : \(SO_3+H_2O\rightarrow H_2SO_4|\)
1 1 1
0,1 0,1
b) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
250ml = 0,25l
\(C_{M_{ddH2SO4}}=0,4\left(M\right)\)
Chúc bạn học tốt
Bài 2 :
\(n_{CuO}=\dfrac{1,6}{80}=0,02\left(mol\right)\)
\(m_{ct}=\dfrac{20.100}{100}=20\left(g\right)\)
\(n_{h2SO4}=\dfrac{20}{98}=0,2\left(mol\right)\)
a) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,02 0,2 0,02
b) Lập tỉ số so sánh : \(\dfrac{0,02}{1}< \dfrac{0,2}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuSO4}=\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
⇒ \(m_{CuSO4}=0,02.160=3,2\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,2-0,02=0,18\left(mol\right)\)
⇒ \(m_{h2SO4\left(dư\right)}=0,18.98=17,64\left(g\right)\)
\(m_{ddspu}=1,6+100=101,6\left(g\right)\)
\(C_{CuSO4}=\dfrac{3,2.100}{101,6}=3,15\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{17,64.100}{101,6}=17,36\)0/0
Chúc bạn học tốt

Cho 8g Lưu huỳnh trioxit tác dụng với nước thu được 250ml dung dịch axit H2SO4.
a. Viết phương trình phản ứng
b. Xác định nồng độ mol axit thu được
số mol SO3 đem phản ứng là :
nSO3 =8/80 = 0.1mol
SO3 +H2O =>H2SO4
Theo pt : nH2SO4 =nSO2 =0.1 mol
=>nồng độ mol/l của axit thu đc là : 0.1 / 0.25 =0.4M

Ta có: \(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right)\)
a. PTHH: SO3 + H2O ---> H2SO4 (1)
b. Theo PT(1): \(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
Đổi 250ml = 0,25 lít
=> \(C_{M_{H_2SO_4}}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)
c. PTHH: H2SO4 + 2KOH ---> K2SO4 + 2H2O
Theo PT(2): \(n_{KOH}=2.n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
=> \(m_{KOH}=0,2.56=11,2\left(g\right)\)
Ta có: \(C_{\%_{KOH}}=\dfrac{11,2}{m_{dd_{KOH}}}.100\%=5,6\%\)
=> \(m_{dd_{KOH}}=200\left(g\right)\)
Ta có: \(d_{KOH}=\dfrac{200}{V_{dd_{KOH}}}=1,045\)(g/ml)
=> \(V_{dd_{KOH}}=191,4\left(ml\right)\)

Đổi 250ml=0,25l
\(SO_3+H_2O\)→\(H_2SO_4\)
+\(n_{SO_3}=\frac{8}{64}=0,125\left(mol\right)\)
+\(n_{H_2SO_4}=n_{SO_3}=0,125\left(mol\right)\)
+\(C_M=\frac{0,125}{0,25}=0,5M\)
ta có 250ml=0,25l
n\(_{SO_3}\)=\(\frac{m_{SO3}}{M_{SO3}}\)= \(\frac{8}{64}\) =0.125 (mol)
a.PTHH:SO3 + H2O-> H2SO4
b.Axit thu được là H2SO4
=> CM=\(\frac{n_{H_2SO_4}}{V_{H_2O}}\) = \(\frac{0.125}{0.25}\) = 0.5 M

a) \(n_{SO_3}=\dfrac{m}{M}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: `SO_3 + H_2O -> H_2SO_4`
b) Theo PTHH: `n_{H_2SO_4} = n_{SO_3} = 0,4 (mol)`
`=> m_{H_2SO_4} = 0,4.98 = 39,2 (g)`
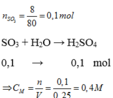
SO3 + H2O → H2SO4
\(n_{SO_3}=\frac{8}{80}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\frac{0,1}{25}=0,004\left(M\right)\)