Cho m gam CaS tác dụng vừa đủ với m1 gam dd HBr 9,72% thu được m2 gam dd muối X% và 672 ml khí H2S(đktc). Tính m, m1,m2, X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



vừa đủ thì dễ rồi
PTHH : \(CaS+2HBr-->CaBr_2+H_2S\uparrow\)
\(n_{H_2S}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
Theo pthh : \(n_{CaS}=n_{H_2S}=0,03\left(mol\right)\)
\(n_{HBr}=2n_{H_2S}=0,06\left(mol\right)\)
\(n_{CaBr_2}=n_{H_2S}=0,03\left(mol\right)\)
\(\Rightarrow\hept{\begin{cases}m_{CaS}=0,03\cdot72=2,16\left(g\right)=m\\m_{ddHBr}=\frac{0,06\cdot81}{9,72}\cdot100=50\left(g\right)=m_1\end{cases}}\)
Theo ĐLBTKL :
\(m_{CaS}+m_{ddHBr}=m_{ddCaBr_2}+m_{H_2S}\)
=> \(2,16+50=m_{ddCaBr_2}+0,03\cdot34\)
=> \(m_{ddCaBr_2}=51,14\left(g\right)=m_2\)
=> \(C\%_{ddCaBr_2}=\frac{0,03\cdot200}{51,14}\cdot100\%\approx11,73\%\)
=> \(x\approx11,73\)
dễ nhưng vẫn nên check lại ...

1/
a)
\(n_{Ba}=\frac{27,4}{137}=0,2mol\); \(n_{H_2SO_4}=\frac{9,8}{98}=0,1mol\)
PTHH: \(Ba+H_2SO_4\rightarrow BaSO_4\downarrow+H_2\uparrow\)
Trước pư: \(0,2\) \(0,1\) \(\left(mol\right)\)
Pư: \(0,1\) \(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư: \(0,1\) \(0\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư còn dư 0,1mol Ba nên Ba tiếp tục pư với H2O trong dd:
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
\(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Tổng số mol H2 sau 2 pư : \(n_{H_2}=0,1+0,1=0,2mol\)
Thể tích khí thu được: \(V_{H_2}=0,2.22,4=4,48l\)
b)
Dd thu được sau pư là dd \(Ba\left(OH\right)_2\)
\(m_{Ba\left(OH\right)_2}=0,1.171=17,1g\)
\(m_{dd}=27,4+100-m_{BaSO_4}-m_{H_2}\)\(=27,4+100-0,1.233-0,2.2=103,7g\)
\(C\%_{ddBa\left(OH\right)_2}=\frac{17,1}{103,7}.100\%\approx16,49\%\)
2/
\(n_{H_2S}=\frac{0,672}{22,4}=0,03mol\)
\(CaS+2HBr\rightarrow CaBr_2+H_2S\uparrow\)
Theo pt:
\(n_{CaS}=n_{CaBr_2}=n_{H_2S}=0,03mol\) ; \(n_{HBr}=0,06mol;\)\(m_{HBr}=0,06.81=4,86g\)
\(m=m_{CaS}=0,03.72=2,16g;\)\(m_{CaBr_2}=0,03.200=6g\)
\(\Rightarrow m_1=\frac{4,86.100}{9,72}=50g\)
Áp dụng ĐLBTKL:
\(m_2=m_{ddCaBr_2}=50+2,16-34.0,03=51,14g\)
\(x=C\%_{CaBr_2}=\frac{6.100}{51,14}\approx11,73\%\)

\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
Giả sử có 1 mol O2 => nH2 = 2mol
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
2 1 ( mol )
\(m_{KMnO_4}=158.2=316g\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
2 2 ( mol )
\(m_{Zn}=65.2=130g\)
\(\dfrac{m_{KMnO_4}}{m_{Zn}}=\dfrac{316}{130}=\dfrac{158}{65}\)

Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe}=n_{H_2}=0,25\left(mol\right)\Rightarrow m_{Fe}=0,25.56=14\left(g\right)=m_1\)
\(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{18,25}{7,3\%}=250\left(g\right)=m_2\)

Bảo toàn khối lượng → mO2= 12,8 (g) → nO2=0,4 mol

Đáp án A

Đáp án A
Bảo toàn khối lượng → mO2= 12,8 (g) → nO2=0,4 mol
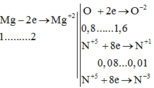
![]()
![]()
n HNO 3 = 10 n N 2 O + 10 n NH 4 + + 2 n O 2 -
= 0,01.10+10.0,04+2.0.4.2 = 2,1mol
→ m H N O 3 = m 2 = 132,3g
→ m1+m2= 151, 2+ 132, 3 = 283,5 (g)