Bài tập về nhôm
Dung dịch A chứa 16,8g NaOH cho tá dụng với dung dịch chứa 8g Fe2(SO4)3. Thêm vào đó 13,68g Al2(SO4)3 thu được 500ml dung dịch B và m gam kết tủa. Tính CM các chất trong B và m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nNaOH = 0,42 mol; nFe2(SO4)3=0,02 mol; nAl2(SO4)3= 0,04 mol
=> Tạo Fe(OH)3 và Fe3+ hết, OH- dư
nFe(OH)2 = nFe2+ = 0,04 mol
nAl3+=0,08 mol; nOH- dư=0,42 – 0,04 . 3 = 0,3 mol
=> tạo hỗn hợp Al(OH)3 : x mol và [Al(OH)4 ]-: y mol
Ta có hệ: x + y = 0,08 và 3x + 4y = 0,3
x = 0,02 và y = 0,06
Vậy khối lượng kết tủa là: m = 5,84g
Dung dịch B gồm Na[Al(OH)4 ]: 0,06 mol
Na2SO4: (0,42 – 0,06)/2 = 0,18 mol
=> CM Na[Al(OH)4 = 0,12M; CM Na2SO4 = 0,36M

Đáp án B
nNaOH = 0,42 mol;
nFe2(SO4)3=0,02 mol;
nAl2(SO4)3= 0,04 mol
=> Tạo Fe(OH)3 và Fe3+ hết, OH- dư
nFe(OH)2 = nFe2+ = 0,04 mol
nAl3+=0,08 mol;
nOH- dư=0,42 – 0,04 . 3 = 0,3 mol
=> tạo hỗn hợp Al(OH)3 : x mol và [Al(OH)4 ]-: y mol
Ta có hệ: x + y = 0,08 và 3x + 4y = 0,3
x = 0,02 và y = 0,06
Vậy khối lượng kết tủa là: m = 5,84g
Dung dịch B gồm Na[Al(OH)4 ]: 0,06 mol
Na2SO4: (0,42 – 0,06)/2 = 0,18 mol
=> CM Na[Al(OH)4 = 0,12M; CM Na2SO4 = 0,36M

Hướng dẫn giải
![]()
=> Tạo Fe(OH)3 và Fe3+ hết, OH- dư

=> tạo hỗn hợp Al(OH)3 : x mol và [Al(OH)4]-: y mol
Ta có hệ: x + y = 0,08 và 3x + 4y = 0,3
x = 0,02 và y = 0,06
Vậy khối lượng kết tủa là: m = 5,84g
Dung dịch B gồm 
![]()
Đáp án B

PTHH: \(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Fe\left(OH\right)_3\downarrow\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
Ta có: \(n_{NaOH\left(p/ứ\right)}=6n_{Fe_2\left(SO_4\right)_3}+6n_{Al_2\left(SO_4\right)_3}=6\cdot\left(\dfrac{8}{400}+\dfrac{13,68}{342}\right)=0,36\left(mol\right)\)
Mà \(\Sigma n_{NaOH}=\dfrac{16,8}{40}=0,42\left(mol\right)\) \(\Rightarrow n_{NaOH\left(dư\right)}=0,06\left(mol\right)\)
PTHH: \(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Al\left(OH\right)_3}=2n_{Al_2\left(SO_4\right)_3}=0,08\left(mol\right)\\n_{NaOH\left(dư\right)}=0,06\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_4}=0,04\cdot3+0,02\cdot3=0,18\left(mol\right)\\n_{NaAlO_2}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Na_2SO_4}}=\dfrac{0,18}{0,5}=0,36\left(M\right)\\C_{M_{NaAlO_2}}=\dfrac{0,06}{0,5}=0,12\left(M\right)\end{matrix}\right.\)

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
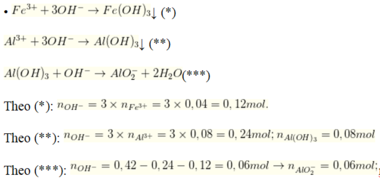
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

có: nNaOH TN1= 1,2. 0,5= 0,6( mol)
nNaOH TN2= 1,2. 0,75= 0,9( mol)
PTPU
6NaOH+ Al2(SO4)3\(\rightarrow\) 2Al(OH)3\(\downarrow\)+ 3Na2SO4 (1)
NaOH+ Al(OH)3\(\rightarrow\) NaAlO2+ 2H2O (2)
từ 2 TN trên ta thấy với cùng một số mol Al2(SO4)3 tác dụng lần lượt với 2 lượng NaOH khác nhau đều thu được m gam kết tủa\(\Rightarrow\) ở TN1 NaOH tác dụng hết với Al2(SO4)3, ở TN2 NaOH còn dư và tiếp tục tác dụng với Al(OH)3 mới tạo thành
\(\Rightarrow\) nAl(OH)3 kết tủa= \(\frac{1}{3}\)nNaOH TN1= 0,2( mol)
\(\Rightarrow\) m= 0,2. 78= 15,6( g)
xét TN2 có:
nNaOH pư(1)= 6a( mol)
nAl(OH)3 pư(1)= 2a( mol)
\(\Rightarrow\) nAl(OH)3 pư(2)= 2a- 0,2( mol)
\(\Rightarrow\) nNaOH pư(2)= 2a- 0,2( mol)
theo giả thiết có:
nNaOH TN2= 6a+ 2a- 0,2
\(\Rightarrow\) 0,9= 8a- 0,2
\(\Rightarrow\) a= 0,1
a)
\(n_{NaOH}\)=0,5.1,2=0,6mol
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,1 0,6 0,3 0,2 (mol)
Sau phản ứng, thu được chất kêt tủa \(Al\left(OH\right)_3\)không tan
\(\Rightarrow m_{\downarrow}=m_{Al\left(OH\right)_3}\)=0,2.78=15,6g
b)
\(n_{Al_2\left(SO4\right)_3}\)=0,1mol
\(n_{NaOH}\)=1,2.0.75=0,9mol
\(Al_2\left(SO4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
bđ 0,1 0,9 0 0
pứ 0,1 0,6 0,3 0,2
spứ 0 0,3 0,3 0,2
Sau phản ứng, thu được chất kết tủa \(Al\left(OH\right)_3\)không tan
\(\Rightarrow m_{\downarrow}=m_{Al\left(OH\right)_3}=0,2.78=15,6g\)
nNaOH= 0,42(mol) ; nAl2(SO4)3= 0,04(mol); nFe2(SO4)3= 0,02(mol).
PTHH:
6NaOH + Fe2(SO4)3 -> 2Fe(OH)3 + 3Na2SO4
Trước phản ứng: 0,42 0,02
Phản ứng: 0,12 0,02 0,04 0,06
Sau phản ứng: 0,3 0 0,04 0,06
6NaOH + Al2(SO4)3-> 3Na2SO4 + 2Al(OH)3
Trước phản ứng: 0,3 0,04
Phản ứng: 0,24 0,04 0,12 0,08
Sau phản ứng: 0,06 0 0,12 0,08
NaOH + Al(OH)3-> NaAlO2 + 2H2O
Trước phản ứng: 0,06 0,08
Phản ứng: 0,06 0,06 0,06 0,12
Sau phản ứng: 0 0,02 0,06 0,12
m= mFe(OH)3 + mAl(OH)3= 107.0,04 + 78.0,02= 5,84 (g)
B: 0,18 mol Na2SO4; 0,06 mol NaAlO2.
500ml=0,5 l
Cm Na2SO4= 0,18/0,5=0,36(M)
Cm NaAlO2 = 0,06/0,5= 0,12(M)