Biết HNO2 có Ka=4.10-4. Tính pH của dung dịch được hình thành khi cho 200ml dung dịch HNO2 0,01M phản ứng với dung dịch NaOH 0,005M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 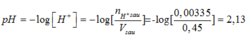

\(n_{H^+}=0.2\cdot0.01\cdot2=0.004\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.01=0.001\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.001.....0.001\)
\(n_{H^+\left(dư\right)}=0.004-0.001=0.003\left(mol\right)\)
\(pH=-log\left(H^+\right)=-log\left(\dfrac{0.003}{0.2+0.1}\right)=2\)
Có: \(n_{H^+}=2n_{H_2SO_4}=2.0,2.0,01=0,004\left(mol\right)\)
\(n_{OH^-}=0,1.0,01=0,001\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
____0,004___0,001 (mol)
\(\Rightarrow n_{H^+\left(dư\right)}=0,003\left(mol\right)\)\\(\Rightarrow\left[H^+\right]=\dfrac{0,003}{0,3}=0,01\)
\(\Rightarrow pH=2\)
Bạn tham khảo nhé!

a)
$NaOH + HCl \to NaCl + H_2O$
$OH^- + H^+ \to H_2O$
b)
$n_{HCl} = 0,1.0,01 = 0,001(mol)$
$n_{NaOH} = 0,2.0,5= 0,1(mol)$
$\Rightarrow$ NaOH dư, HCl hết
$n_{NaOH\ pư} = 0,001 \Rightarrow n_{NaOH\ dư} = 0,1 - 0,001 = 0,099(mol)$
$\Rightarrow [OH^-] = \dfrac{0,099}{0,1 + 0,2} = 0,33M$
$\Rightarrow pOH = -log(0,33) = 0,48 $
$pH = 14 - pOH = 14 - 0,48 = 13,52$

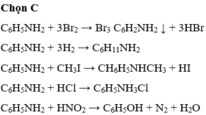
Đáp án C
C6H5NH2 + 3Br2 → Br3 C6H2NH2 ↓ + 3HBr
C6H5NH2 + 3H2 → C6H11NH2
C6H5NH2 + CH3I → CH6H5NHCH3 + HI
C6H5NH2 + HCl → C6H5NH3Cl
C6H5NH2 + HNO2 → C6H5OH + N2 + H2O
Đáp án C.

( N H 4 ) ( C H 3 C H 2 N H 3 ) C O 3 thỏa mãn vì + NaOH tạo etylamin và amoniac đều là khí làm quì ẩm hóa xanh; trong đó etylamin phản ứng với H N O 2 t a o N 2 ; chất vô cơ sau phản ứng chính là N a 2 C O 3 .
Đáp án cần chọn là: D
Đề thiếu à b, bao nhiêu ml NaOH 0,005M
200ml nhé bạn