Cho 100ml dung dịch ba(oh)2 có ph=12. Số mol của ba(oh)2 là A.5.10-⁴mol B.10-⁴mol C.10-³mol D.0.02mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
\(n_{NaCl}=\dfrac{5,85}{58,5}=0,1\left(mol\right)\Rightarrow C_{M_{ddNaCl}}=\dfrac{0,1}{0,1}=1M\)
\(n_{KOH}=\dfrac{5,6}{56}=0,1\left(mol\right)\Rightarrow C_{M_{ddKOH}}=\dfrac{0,1}{0,1}=1M\)
\(n_{CaCl_2}=\dfrac{11,1}{111}=0,1\left(mol\right)\Rightarrow C_{M_{ddCaCl_2}}=\dfrac{0,1}{0,1}=1M\)
Câu 2:
a,\(n_{Ba\left(OH\right)_2}=0,2.1,5=0,3\left(mol\right)\)
b,\(C\%_{ddHCl}=\dfrac{0,2.36,5.100\%}{200}=3,65\%\)
\(C\%_{ddH_2SO_4}=\dfrac{0,1.98.100\%}{200}=4,9\%\)

Đáp án A
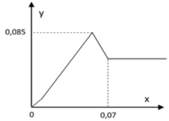
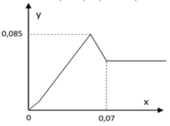
Tại y = 0,085 Þ 3a + b + 2a = 0,085 (1)
Tại x = 0,07 Þ 2a.4 + 2b = 0,07.2 (2)
Từ (1), (2) suy ra: a = 0,015; b = 0,01 Þ a : b = 3 : 2

Giải thích:
Do khi số mol Ba(OH)2 bằng 0,9 hay 1,0 mol số mol kết tủa là 3a mol
khi số mol Ba(OH)2 bằng 0,7 mol số mol kết tủa là 4a mol
=> Khi nBa(OH)2 = 0,9 mol thì Al(OH)3 đã bị hòa tan hết, kết tủa chỉ còn lại BaSO4
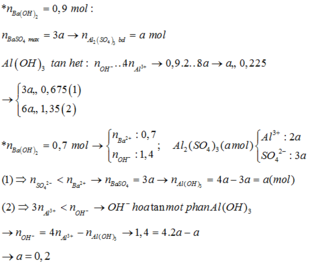
Đáp án A

Đáp án C
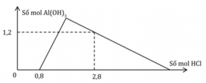
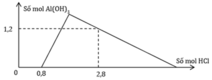
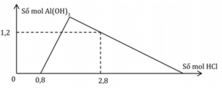
Giai đoạn 1: H+ + OH− → H2O
Ta có:
![]()
![]()
Giai đoạn 2:
H+ + AlO−2 + H2O → Al(OH)3
2a ← 2a → 2a
3H+ + Al(OH)3 → Al3+ + 3H2O
3(1,2 ─ 2a) ← 1,2 ─ 2a
Ta có:
![]()
=> a = 0,7
Vậy a:b = 0,7:0,4 = 7:4
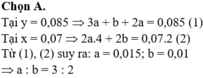


Ta có: \(14+log\left(x\right)=12\)
\(\Leftrightarrow log\left(x\right)=-2\)
\(\Leftrightarrow x=0,01M\)
\(\Rightarrow n_{OH^-}=0,01.0,1=0,001\left(mol\right)\)
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,001.2=0,002\left(mol\right)\)
⇒ Chọn D (câu D bn viết thiếu 1 số 0)