Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Ta có: \(n_{HNO_3}=0,1\cdot0,25=0,025\left(mol\right)=n_{H^+}=n_{NO_3^-}\)
b) Ta có: \(n_{Ba\left(OH\right)_2}=0,2\cdot0,15=0,03\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Ba^{2+}}=0,03\left(mol\right)\\n_{OH^-}=0,06\left(mol\right)\end{matrix}\right.\)
c) Ta có: \(n_{Al_2\left(SO_4\right)_3}=0,2\cdot0,2=0,04\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al^{3+}}=0,08\left(mol\right)\\n_{SO_4^{2-}}=0,12\left(mol\right)\end{matrix}\right.\)

Đáp án C
Do cho 0,02 mol hoặc 0,04 mol CO2 hấp thụ hết vào dung dịch Ba(OH)2 thì lượng kết tủa thu được đều bằng nhau nên chứng tỏ khi n C O 2 = 0,02 mol thì kết tủa chưa bị hòa tan, còn khi n C O 2 = 0,04 mol thì kết tủa bị hòa tan một phần
- Khi n C O 2 = 0,02 mol
CO2+ Ba(OH)2 → BaCO3+ H2O
Ta có: n C O 2 = n B a C O 3 = 0,02 mol
- Khi n C O 2 = 0,04 mol
CO2+ Ba(OH)2 → BaCO3+ H2O
0,02 0,02 0,02
2CO2 + Ba(OH)2 → Ba(HCO3)2
(0,04-0,02)→ 0,01
Ta có: n B a ( O H ) 2 = 0,02+ 0,01 = 0,03 mol

Chọn B
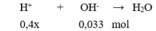
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09

Đáp án A
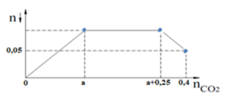
Khi nCO2 = 0,4 mol thì nkt = 0,05 mol => 0,05 = 2a + b – 0,4 => 2a + b = 0,45
Đoạn đồ thị đi ngang coi như CO2 tác dụng với NaOH tạo NaHCO3
=> b = 0,25 mol => a = 0,1


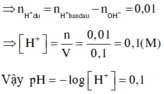
Ta có: \(14+log\left(x\right)=12\)
\(\Leftrightarrow log\left(x\right)=-2\)
\(\Leftrightarrow x=0,01M\)
\(\Rightarrow n_{OH^-}=0,01.0,1=0,001\left(mol\right)\)
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,001.2=0,002\left(mol\right)\)
⇒ Chọn D (câu D bn viết thiếu 1 số 0)