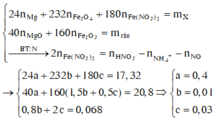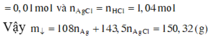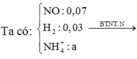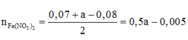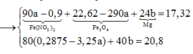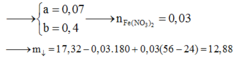cho 15,25g hỗn hợp gồm 1kim loại hóa trị II có lẫn Fe tan hết trong HCl thu được 4,48l khí H2 ở đktc và dung dịch X thêm NaOH dư vào dung dịch X lọc kết tủa rồi nung trong không khí đến khối lượng không đổi thu được 12g chất rắn.tìm kim loại hóa trị II.biết rằng nó không tạo kết tủa với hidroxit.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi kim loại hóa trị II là Mpt pứ:M+2HCl−−−>MgCl2+H2Fe+2HCl−−−>FeCl2+H2dd X: MgCl2,FeCl2,HCldưThêm NaOH dư vào X và biết nó không tạo kết tủa với hidroxit nên ta có pt pứFeCL2+2NaOH−−−>Fe(0H)2+2NaCl4Fe(OH)2+02−−−>2Fe203+4H20n Fe203 = 0, 075 moltừ các pt pu --->n H2= n Fe= n FeCl



| CHÚ Ý |
| + Với các bài toán liên quan tới tính oxi hóa của trong môi trường H+ thì khi có khí H2 bay ra → toàn bộ N trong phải chuyển hết vào các sản phẩm khử. + Liên qua tới Fe thì khi có khí H2 thoát ra dung dịch vẫn có thể chứa hỗn hợp muối Fe2+ và Fe3+. |

Đáp án A
Đặt số mol Mg, F e 3 O 4 v à F e ( N O 3 ) 2 lần lượt là x, y , z mol
Hỗn hợp khí có 30 > M > 21,6 > 2 và có 1 khí hóa nâu => Z gồm NO: a mol và H 2 : b mol
Khi đó ta có hệ 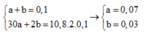
Vì sinh ra H 2 nên toàn bộ lượng N O 3 - trong F e ( N O 3 ) 2 v à H N O 3 chuyển hóa thành NO: 0,07 mol và N H 4 +
Bảo toàn nguyên tố N ![]()
Luôn có ![]()
![]()
![]()
![]()
Trong 20,8 gam chất rắn gồm MgO: x mol và ![]()
Ta có hệ 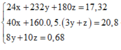
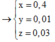
Bảo toàn electron cho toàn bộ quá trình ![]()
![]()
=>Kết tủa thu được AgCl: 1,04 mol, Ag: 0,01 mol ![]() = 150,32 gam
= 150,32 gam

Đáp án B
Gọi a, b và c lần lượt là số mol của Mg, Fe3O4 và Fe(NO3)2.
Hỗn hợp khí Y gồm NO (0,07 mol) và H2 (0,03 mol).
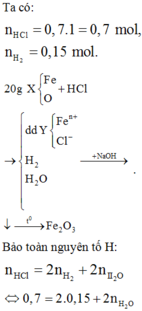
Cho 8,66 gam X tác dụng với dung dịch hỗn hợp HCl và HNO3 thì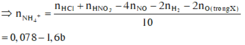
Cho Y tác dụng với NaOH, lọc kết tủa đun nóng thu được 10,4 gam hỗn hợp rắn gồm MgO (a mol) và Fe2O3 (1,5b + 0,5c) mol. Từ dữ kiện đề bài ta có hệ sau