hòa tan haonf taonf 3.48 g một oxit sắt vào lượng dư dd hcl thu dc dung dịch X.cho X tác dụng vs dd NaOH dư lọc kết tủa nung trong không khí đến khối lượng ko đổi thu dc 3.6 g một chất rắn khan .xác định ct oxit sắt
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


khi cho Fe vào HCl tạo Fe2+
áp dụng định luật bảo toàn e ta có:
Fe => Fe2+ + 2e 2H+ +2e => H2
nFe = 0,05 mol => mFe=2,8 g => mFe2O3 =7,2g => nFe2O3=0,045 mol
nói chung khi nung kết tủa trong không khí đều tạo Fe2O3 => m (chất rắn)= 7,6 g

\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
Ta có :
\(n_{Fe_2O_3}=\dfrac{16}{160}=0.1\left(mol\right)\)
Dựa vào PTHH ta thấy :
\(n_{Fe}=2\cdot n_{Fe_2O_3}=2\cdot0.1=0.2\left(mol\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\)
\(\Rightarrow m_{Al}=19.3-11.2=8.1\left(g\right)\)
\(\%Al=\dfrac{8.1}{19.3}\cdot100\%=41.96\%\)

Hòa tan bằng H2SO4 => Cu không tác dụng
Cho tác dụng NaOH dư chỉ còn lại kết tủa của Fe
Nung hidoxit của Fe trong không khí => thu được Fe2O3 => Đap an D

Sản phẩm cuối cùng sẽ chỉ có Fe2O3, bảo toàn Fe
=> n Fe2O3 = 0,45=> m = 72 gam
=> Đáp án D



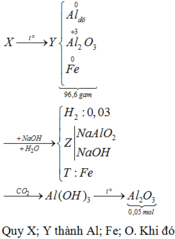
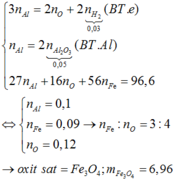
FexOy+2y HCl -------> xFeCl2y/x+ yH2O (1)
xFeCl2y/x+ 2yNaOH ---->xFe(OH)2y/x+2yNaCl (2)
2xFe(OH)2y/x+ (-4y-6x)/2 O2 -----> xFe2O3+ 2yH2O (3)
nFe2O3=0.0225 mol
Theo(3) nFe(OH)2y/x=2nFe2O3=0.045 mol
Theo(2) nFeCl2y/x=nFe(OH)2y/x=0.045 mol
Theo(1) nFexOy=1/xnFeCl2y/x=0.045/x mol
=> MFexOy=3.48/(0.045/x)=232x/3
Hay: 56x+ 16y=232x/3
=>x/y=3/4=> x=3; y=4
Vậy CTHH Fe3O4