Hòa tan 12,8 g hỗn hợp gồm Cu và CuO trong dung dịch H2SO4 đặc,nóng( vừa đủ) thu được 3,36 lít khí SO2 (đktc) là sản phẩm khử duy nhất. Viết phương trình hóa học. Cho biết phản ứng nào là phản ứng oxi hóa-khử? Tính phần trăm khối lượng của Cu và CuO, khối lượng muối sunfat thu được, tính khối lượng dung dịch H2SO4 98% đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\)(Phản ứng oxi hóa-khử)
\(Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
\(b) n_{SO_2} = \dfrac{672}{1000.22,4} = 0,03(mol)\\ n_{Fe}= \dfrac{2}{3}n_{SO_2} = 0,02(mol)\\ \%m_{Fe} = \dfrac{0,02.56}{2,72}.100\% = 41,18\%\\ \%m_{Fe_2O_3} = 100\% -41,18\% = 58,82\%\)

Đáp án A
Gọi số mol Fe là a; số mol O là b; số mol Cu là c
Khi đó 56a + 16b +64c = 2,44
Bảo toàn e có 3a + 2c =2b + 0,045
Khối lượng muối sunfat là 200a + 160c = 6,6
→ a = b = 0,025; c = 0,01

Đáp án A
Gọi số mol Fe là a; số mol O là b; số mol Cu là c
Khi đó 56a + 16b +64c = 2,44
Bảo toàn e có 3a + 2c =2b + 0,045
Khối lượng muối sunfat là 200a + 160c = 6,6
→ a = b = 0,025; c = 0,01




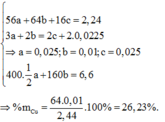

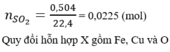
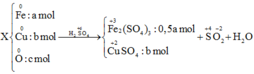
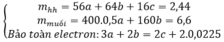
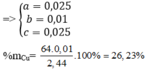

\(CuO+H_2SO_{4\left(đn\right)}\rightarrow CuSO_4+H_2O\)
0,04 0,04 (mol)
Cu+\(2H_2SO_{4\left(đn\right)}\rightarrow CuSO_4+SO_2+2H_2O\)
0,15 0,15 0,15 (mol)
n\(_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
phản ứng trên là phản ứng oxi hóa-khử[Cu:0\(\rightarrow\)+2(chất khử);\(H_2SO_4:+6\rightarrow+4\)(chất oxi hóa)]
n\(_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{CuO}=12,8-9,6=3,2\left(g\right)\)
\(\rightarrow\%m_{CuO}=\dfrac{3,2}{12,8}.100=25\%\)
\(n_{CuO}=\dfrac{3,2}{80}=0,04\left(mol\right)\)
\(\rightarrow\%m_{Cu}=\dfrac{9,6}{12,8}.100=75\%\)
\(m_{CuSO_4}=\left(0,15+0,04\right).160=30,4\left(g\right)\)