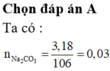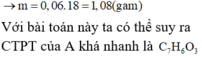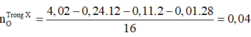Một hợp chất B chứa C, H, O có CTPT trùng với CT đơn giản nhất. Khi phân tích a g B thấy tổng khối lượng hiđrô và oxi là 0,46g. Để đốt cháy hoàn toàn a g B cần 0,896l khí O2 ( đktc ). Sản phẩm cháy dẫn qua bình NaOH dư thấy khối lượng tăng thêm 1,9g. Xác định CTPT B và tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo định luật bảo toàn khối lượng :
![]()
Đặt số mol C O 2 là a, số mol N2 là b, ta có :
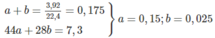
Khối lượng C: 0,150 x 12,0 = 1,80 (g).
Khối lượng H: 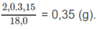
Khối lượng N: 0,0250 x 28,0 = 0,700 (g).
Khối lượng O: 4,48 - 1,80 - 0,35 - 0,700 = 1,60 (g).
Chất A có dạng C x H y N z O t
x : y ; z : t = 0,15 : 0,35 : 0,05 : 0,10 = 3 : 7 : 1 : 2
Công thức đơn giản nhất của A là C 3 H 7 N O 2

Đáp án B
, nCO2 = nBaCO3 = 0,2 mol
, mdd giảm = mBaCO3 – (nCO2 + nH2O) => nH2O = 0,35 mol
Xét 6,75g A phản ứng tạo 0,075 mol N2
=> Vậy 4,5 g A thì tạo 0,05 mol N2
=> nN(A) = 0,1 mol
Ta có : mA = mC + mH + mO + mN => nO = 0
=> nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1
=> CTĐG nhất và cũng là CTPT của A là C2H7N

Định hướng tư duy giải
Từ các dữ kiện của bài toán biện luận ra X chứa CH3COOH và HOOC – CH2 – COOH
Ta có:
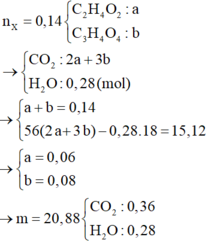

Đáp án B
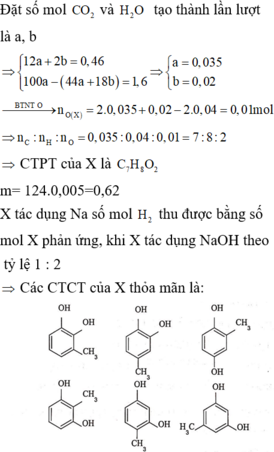
Đặt nC = x; nH = y
12x + y = 0,46 và 100x – 44x - 9y = 1,6 → x = 0,035; y = 0,04
nO = 0,035.2 + 0,04/2 – 0,04.2 = 0,01
C : H : O = 0,035 : 0,04 : 0,01 = 7 : 8 : 2 → C7H8O2
nX = nC/7 = 0,005 mol ; → mx = 0,62g
có 2 nhóm OH gắn vào vòng
o-HO-C6H4-OH có 2 vị trí gắn CH3
m- HO-C6H4-OH có 3 vị trí gắn CH3
p-HO-C6H4-OH có 1 vị trí gắn CH3
Vậy có 6 CTCT đúng

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
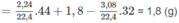
Khối lượng C trong 1,8 g A là: 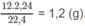
Khối lượng H trong 1,8 g A là: 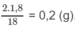
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
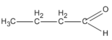 (butanal)
(butanal)
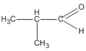 (2-metylpropanal)
(2-metylpropanal)
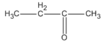 (butan-2-ol)
(butan-2-ol)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,2\left(mol\right)\Rightarrow m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
c, \(n_{O_2}=\dfrac{5}{4}n_P=0,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,5.22,4=11,2\left(l\right)\)
d, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{3}\left(mol\right)\Rightarrow m_{KClO_3}=\dfrac{1}{3}.122,5=\dfrac{245}{6}\left(g\right)\)