Hòa tan hỗn hợp gồm 37,2g Zn và Fe trong 1 mol dung dịch H2SO4.
a) CMR hỗn hợp tan hết
b) Nếu hòa tan hỗn hợp trên với lượng gấp đôi và cùng lượng axit trên thì có tan hết không?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Zn (Do MFe < MZn)
\(n_{Zn}=\dfrac{37,2.2}{65}=\dfrac{372}{325}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
\(\dfrac{372}{325}\)--> \(\dfrac{372}{325}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{372}{325}>1\)
=> A không tan hết
a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
\(n_{H_2SO_4\left(pư\right)}=2.\dfrac{93}{140}=\dfrac{93}{70}>1\)
=> A không tan hết

a. Có các phản ứng hóa học xảy ra:
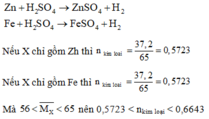
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A

a.
Số mol H2: nH2=2,24/22,4 =0,1 mol
Vì chỉ có Ca tác dụng với nước nên:
PT: Ca + 2H2O-->Ca(OH)2 + H2
0,1<--------------------------0,1 mol
Khối lượng Ca: mCa=0,1.40=4 g
mMg=8,8-4=4,8 g
b.
Trong hỗn hợp A:
nCa=4/40=0,1 mol
nMg=4,8/24=0,2 mol
PT:
Ca + 2HCl------->CaCl2 + H2
0,1-----------------------------0,1 mol
Mg + 2HCl-------->MgCl2 + H2
0,2--------------------------------0,2 mol
nH2=0,1 + 0,2=0,3 mol
Thể tích H2:
VH2=0,3.22,4=6,72 l

m hỗn hợp = 27,2 gam
=> \(\frac{27,2}{65}< n_{KL}< \frac{27,2}{56}\)
<=> 0,418 < nKL < 0,485 mol
Gọi CT chung 2 kim loại là R
R + H2SO4 -> RSO4 + H2
Dễ thây nR = nH2SO4
=> Số mol axit cần để hòa tan: 0,418 < nH2SO4 < 0,485 mol <1 mol H2SO4.
=> Axit dư, KL tan hết.
b. Khi tăng lượng KL gấp đôi ta có
0,418x2 < nhh < 0,485x2 (mol)
nKL < 1 mol => KL vẫn tan hết.

Đáp án A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , nFe2(SO4)3 = y
⇒mdd = 152 x + 400y = 51,76
nFe = nFeSO4 +2.nFe2(SO4)3 = x+ 2y = 0,29
⇒x= 0,13 mol , y= 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
⇒b = 0,37.98/9,8% = 370g
\Rightarrow
a/
n H2S04 = 1
n Zn = a
n Fe = b
=> 65a + 56b = 37,2 (*)
Giả sử hỗn hợp chỉ chứa toàn Zn thì ta có:
65a + 56b = 37,2
=> 65(a + b) > 37,2
<=> a + b > 0,57 (1)
Giả sử hỗn hợp toàn Fe thì ta cũng có:
56(a + b) < 37,2
<=> a + b < 0,66 (2)
Zn + H2S04 --> ZnS04 + H2
a........a
Fe + H2S04 --> FeS04 + H2
b.........b
Tổng n H2S04 = a + b = 1 mol
Mà theo 1 và 2 thấy
0,57 < a + b < 0,66
=> chứng tỏ rằng hỗn hợp này tan hết, axit dư
b/
nếu dùng 1 lượng Zn và Fe gấp đôi trường hợp trước
=> 0,57*2 < a + b < 0,66*2
<=> 1,14 < a + b < 1,32
lượng H2SO4 vẫn như cũ vẫn là 1 mol
=> hỗn hợp ko tan hết