Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , nFe2(SO4)3 = y
⇒mdd = 152 x + 400y = 51,76
nFe = nFeSO4 +2.nFe2(SO4)3 = x+ 2y = 0,29
⇒x= 0,13 mol , y= 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
⇒b = 0,37.98/9,8% = 370g

Đáp án A
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a ; nFe2(SO4)3 =b
⇒152a + 400b = 51,76
BT Fe: a + 2b = 0,145 . 2 = 0,29 ⇒ a= 0,13 mol; b= 0,08 mol
BT S: nH2SO4 = n FeSO4 + 3nFe2( SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒b= 0,37 .98 /0,098 =370g

Chọn đáp án C
Ta thấy: Fe, Cu, Ag + dd X → chỉ còn lại Ag không tan đúng bằng lượng Ag ban đầu
=> ddX hòa tan được Fe, Cu mà không sinh ra Ag
=> X chỉ có thể là Fe2(SO4)3
Fe + Fe2(SO4)3 → 3FeSO4
Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4
=> chọn C

Chọn đáp án B
(1) Hỗn hợp Na2O + Al2O3(tỉ lệ mol 1:1) tan hết trong nước dư.
Đúng. Nhận xét nhanh chất tan là NaA1O2 nên thỏa mãn
(2) Hỗn hợp Fe2O3+ Cu (tỉ lệ mol 1:1) tan hết trong dung dịch HC1 dư.
Đúng. Vì 2Fe3+ + Cu ® 2Fe2+ + Cu2+
(3) Hỗn hợp KNO3 + Cu (tỉ lệ mol 1:1) tan hết trong dung dịch H2SO4 loãng dư.
Đúng. Vì 4H+ + N O 3 - + 3e → NO+2H2O Do đó số mol e nhận tối đa là 3
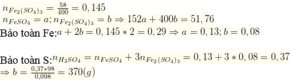

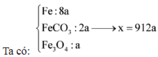
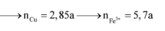
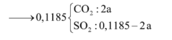
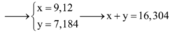

a. Có các phản ứng hóa học xảy ra:
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A
tại sao nH2SO4 lại bằng nkim loại