Cho 4,48 lít khí CO (đktc) tác dụng với FeO ở nhiệt độ cao. Sau phản ứng thu được chất khí A có khối lượng bé hơn 1,6g so với lượng FeO ban đầu. Tính khối lượng Fe thu được và % thể tích hỗn hợp khios sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$FeO + CO \xrightarrow{t^o} Fe + CO_2$
Theo PTHH : $n_{FeO} = n_{CO\ pư} = n_{Fe} = n_{CO_2} = a(mol)$
$\Rightarrow m_{giảm} = m_{FeO} - m_{Fe} = 72a -56a = 16a = 1,6(gam)$
$\Rightarrow a = 0,1(mol)$
$m_{Fe} = 0,1.56 = 5,6(gam)$
$n_{CO\ dư} = 0,2 - 0,1 = 0,1(mol)$
$\%V_{CO\ dư} = \%V_{CO_2} = \dfrac{0,1}{0,1 + 0,1}.100\% = 50\%$

Đặt :
nFeO = x mol
FeO + CO -to-> Fe + CO2
x_____x_______x_____x
m giảm = mFeO - mFe = 1.6
<=> 72x - 56x = 1.6
=> x = 0.1
mFe = 0.1*56 = 5.6 g
nCO dư = 0.2 - 0.1 = 0.1 mol
nCO2 = 0.1 mol
Vì : %V = %n
%CO = %CO2 = 0.1/0.2 *100% = 50%
Đặt \(n_{FeO}=x\left(mol\right)\)
\(FeO+CO\underrightarrow{t^o}Fe+CO_2\)
x → x
\(m_{giảm}=m_{FeO}-m_{Fe}=1,6\)
\(\Leftrightarrow72x-56x=1,6\)
\(\rightarrow x=0,1\)\(\rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(n_{CO}dư=0,2-0,1=0,1\left(mol\right)\)
→\(n_{CO_2}=0,1\left(mol\right)\)
mà \(\%V=\%n\)
%CO=%CO2\(\frac{0,1}{0,2}\).100%=50%

Đáp án D
Các phản ứng xảy ra:
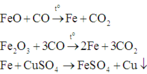
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
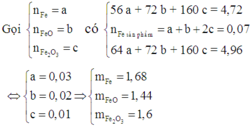

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt

a)
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
$m_{FeO} = 12 - 8,4 = 3,6(gam)$
$n_{FeO} =0,05(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} + 2n_{FeO} = 0,4(mol)$
$V_{dd\ HCl} = \dfrac{0,4}{2} = 0,2(lít)$
c) $Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = 0,15(mol) \Rightarrow m_{chất\ rắn} = m_{FeO} + m_{Cu}$
$= 3,6 + 0,15.64 = 13,2(gam)$

Vì Cu không tác dụng với HCl, nên chỉ có phản ứng của Fe.
PTHH: Fe+2HCl\(\rightarrow\)FeCl2+H2
a) nH2=0,15(mol)
Theo pt: nFe=nH2=0,15 (mol)
\(\Rightarrow\)mFe=8,4(g)
b) mCu=10-8,4=1,6(g)
c) Theo pt: nHCl=nH2=0,15(mol)
\(\Rightarrow\)VHCl=0,3(l)
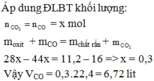
nCO phản ứng = nCO2 = nFe = nO = 0,1
→ mFe = 5,6g
nCO2 dư = 0,2 - 0,1 = 0,1
→ %VCO2 = 50%
FeO + CO -> Fe + CO2
nCO=0,2(mol)
Đặt nFeO tham gia PƯ=a
Ta có:
72a-56a=1,6
=>a=0,1
Theo PTHH ta có:
nFe=nCO2=nFeO tham gia PƯ=0,1(mol)
mFe=56.0,1=5,6(g)
%VCO2=\(\dfrac{0,1}{0,2}.100\%=50\%\)
%VCO=100-50=50%