bài 1: Hãy tìm CTHH của một hợp chất có chứa 36,8% Fe;16,5 S và còn lại là O . Biết khối lượng mol của hợp chất là 152 g/mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


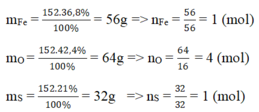
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.

Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Khối lượng mol của Fe là \(M_{Fe}\) = (152 . 36,8)/100 = 56 g
Khối lượng mol của S là: \(M_S\) = (152 . 21)/100 = 32 g
Khối lượng mol của O là: \(M_O\) = (152 . 42,2)/100 = 64 g
Gọi công thức hóa học của hợp chất là \(Fe_xS_yO_z\), ta có:
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.z=64\Rightarrow z=4\)
Vậy hợp chât có công thức hóa học là \(FeSO_4\)

a, theo đề ta có:
MFexOy=160g/mol
=>ptk FexOy=160 đvC
Fex=160:(7+3).7=112đvC
=>x=112/56=2
Oy=160-112=48đvC
=>y=48/16=3
vậy CTHH của hợp chất A=Fe2O3
b. đề thiếu hả nhìn ko hỉu

\(Fe_2O_3 \to Fe: III\\ Fe_x^{III}(SO_4)_y^{II}\\ \to III.x=II.y\\ \frac{x}{y}=\frac{2}{3}\\ \to Fe_2(SO_4)_3\)

NaOH, Fe(OH)3 là bazơ
CaO là oxit bazơ
SO3 là oxit axit
CuCl2, KHCO3 là muối
H2SO4 là axit
NaOH -> Bazo
CaO -> Oxit
SO3 -> Oxit
CuCl2 -> Muối
H2SO4 -> axit
KHCO3 -> muối
Fe(OH)3 -> Bazo

bài 1: gọi công thức là FexOy ta có tỉ lệ :
x:y=\(\frac{72,414}{56}:\frac{27,586}{16}=3:4\)
vậy CTHH: Fe3O4
Bài 2: gọi CT: SxOy
mà x:y=\(\frac{32}{2}:\frac{16}{3}=1:3\)
vậy CT là SO3
PTK=16.3+32=80 g/mol
Sửa đề:bài 1: Hãy tìm CTHH của một hợp chất có chứa 36,8% Fe;21% S và còn lại là O . Biết khối lượng mol của hợp chất là 152 g/mol
Gọi CTHH của HC là FexSyOz
x=\(\dfrac{152.36,8\%}{56}=1\)
y=\(\dfrac{152.16,5\%}{32}=1\)
z=\(\dfrac{152-56-32}{16}=4\)
Vậy CTHH của HC là FeSO4
Bài 2: Hãy tìm CTHH của một hợp chất có chứa27,1%Fe;16,5%N và còn lại là O . Biết khối lượng mol của hợp chất là 85 g/mol