1 nguyên tố R tạo được 2 hợp chất oxit R2Oa và R2Ob biết rằng % khối lượng O trong R2Oa và R2Ob lần lượt là 22,222% và 30%.Hãy xác định công thức các oxit trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức 2 oxit là A 2 Ox và A 2 Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
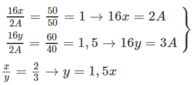
Chỉ có các cặp x, y sau có thể chấp nhận :
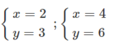
- Nếu chọn x = 2 → ta có 32 = 2A → A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 → ta có 64 = 2A → A = 32 → A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : S O 2 và S O 2

Theo đề có:
\(\%_{Cl\left(MCl_x\right)}:\%_{Cl\left(MCl_y\right)}=\dfrac{1}{1,173}\)
\(\Leftrightarrow\dfrac{35,5x}{M+35,5x}:\dfrac{35,5y}{M+35,5y}=\dfrac{1}{1,173}\)
\(\Leftrightarrow\dfrac{35,5x\left(M+35,5y\right)}{35,5y\left(M+35,5x\right)}=\dfrac{1}{1,173}\)
\(\Leftrightarrow1,173x\left(M+35,5y\right)=y\left(M+35,5x\right)\)
\(\Leftrightarrow1,173xM+41,6415xy-yM-35,5xy=0\\ \Leftrightarrow1,173xM+6,1415xy=yM\left(1\right)\)
Lại có:
\(\%_{O\left(MO_{0,5x}\right)}:\%_{O\left(M_2O_y\right)}=1:1,352\)
\(\Leftrightarrow\dfrac{0,5x.16}{M+0,5x.16}:\dfrac{16y}{2M+16y}=1:1,352\)
\(\Leftrightarrow\dfrac{8x\left(2M+16y\right)}{16y\left(M+8x\right)}=\dfrac{1}{1,352}\)
\(\Leftrightarrow21,632xM+173,056xy-16yM-128xy=0\\ \Leftrightarrow21,632xM+45,056xy=16yM\)
\(\Rightarrow1,352Mx+2,816xy=yM\left(2\right)\)
Từ (1), (2) có: \(1,173xM+6,1415xy=1,352xM+2,816xy\)
\(\Leftrightarrow1,173xM+6,1415xy-1,352xM-2,816xy=0\\ \Leftrightarrow-0,179xM=-3,3255xy\\ \Rightarrow M=18,6y\)
Biện luận với y = 3 => M = 56
Thế y = 3 vào (1) được x = 2
=> CTPT của các hợp chất trên: \(FeCl_2,FeCl_3,FeO,Fe_2O_3\)

gọi cthh của X là R2Oa
%O = 47,06% => %R=52,94%
=>\(\dfrac{2R}{aO}=\dfrac{52,94}{47,06}\Rightarrow2R.47,06=a.16.52,94\)
=> R = 847,04a:94,2 = 9a
Biện luận:
nếu a = 1
=> R = 9 (loại)
nếu a =2
=> R = 18 (loại)
nếu a = 3
=> R =27 ( nhận)
=> R là Al (nhôm)
Vậy cthh của oxit là Al2O3

b) CT hợp chất của R với hidro là RH3
Có \(\dfrac{3}{M_R+3}.100\%=8,82\%=>M_R=31\left(P\right)\)
CT oxit cao nhất: P2O5
CT hidroxit: H3PO4
c) CT oxit cao nhất: RO2
\(\dfrac{32}{M_R+32}.100\%=53,3\%\) => MR = 28 (Si)

B: RH 3 → % m R = R/R+3 x 100 = 82,35
→ R = 14(N) → A,B là N 2 O 5 và NH 3
Cho em hỏi làm sao mình biết đc R có hoá trị 3 khi tác dụng với hidro ạ.

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

Ta có:
\(\dfrac{2R}{2R+16a}=\dfrac{2}{9}\)
\(\dfrac{2R}{2R+16b}=0,3\)
giải 2 cái này ra coi thử