Hòa tan hoàn toàn 31,3 g hỗn hợp X gồm Na2CO3 và K2CO3 vào nước dư thu được dung dịch Y. Nhỏ từ từ tới hết 150ml dung dịch HCl 2M vào Y. Sau phản ứng thu được 1,12 lít CO2 (đktc) và dung dịch Z. Thêm Ba(OH)2 dư vào Z thu được m gam kết tủa. Khối lượng K2CO3 trong hỗn hợp X là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CO_3^{2-}}=0,1\left(mol\right);n_{HCO_3^-}=0,2\left(mol\right);n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(CO_3^{2-}+H^+\text{→}HCO_3^-\)
0,1 0,1 0,1 (mol)
\(HCO_3^-+H^+\text{→}CO_2+H_2O\)
0,15 0,15 0,15 (mol)
Suy ra :
\(V=\dfrac{0,1+0,15}{1}=0,25\left(lít\right)\)

Đáp án C
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + OH- → 2AlO2- + H2O
⇒Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO2-
AlO2- + CO2 + H2O → Al(OH)3 + HCO3-

Đáp án D
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)

Đáp án A
Sơ đồ phản ứng :
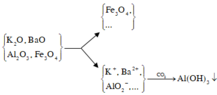
Chất rắn Y có Fe3O4 và có thể còn Al2O3 chưa phản ứng hết. Dung dịch X có có Ba2+, K+, AlO 2 - và có thể có OH - . Sục CO2 dư vào X chỉ thu được kết tủa là Al(OH)3.
Phương trình phản ứng :
![]()
Giả sử trong Y có OH - thì do CO2 có dư nên xảy ra phản ứng :
![]()
Do đó không thể có kết tủa BaCO3.

Chọn A
Chất rắn Y có Fe3O4 và có thể còn Al2O3 chưa phản ứng hết. Dung dịch X có có Ba2+, K+, A l O 2 - và có thể có O H - . Sục CO2 dư vào X chỉ thu được kết tủa là Al(OH)3.

Đáp án C
Al2O3 + 2OH- + 3H2O → 2Al(OH)4-
Al(OH)4- + CO2 → Al(OH)3 + HCO3-

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

$n_{HCl} = 0,3(mol) ; n_{CO_2} = 0,05(mol)$
\(CO_3^{2-}+H^+\rightarrow HCO_3^-\)
0,25.......0,25..........................(mol)
\(HCO_3^-+H^+\text{→}CO_2+H_2O\)
0,05........0,05....0,05........................(mol)
Gọi $n_{Na_2CO_3} = a(mol) ; n_{K_2CO_3} = b(mol) \Rightarrow 106a + 138b = 31,3(1)$
Ta có :
$n_{CO_3^{2-}} = a + b = 0,25(2)$
Từ (1)(2) suy ra a = 0,1 ;b = 0,15
$m_{K_2CO_3} = 0,15.138 = 20,7(gam)$
0,25 mol là chỗ nào ra vậy ạ