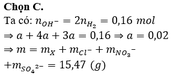Hòa tan hoàn toàn 3g hỗn hợp X gồm 1 kim loại kiềm và 1 kim loại kiềm thổ vào nước thu được dung dịch Y là 1,792 lít H2 (dktc). Trung hòa vừa hết dung dịch Y bằng V ml dung dịch Z gồm H2SO4 2M và HCl 1M tạo ra m gam hỗn hợp muối. Tính V? m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Có nH2SO4 = x mol; n HCl = 2x mol
4x = 0,024.2 ⇒ x = 0,012 mol
⇒ m muối = 1,788 + 0,024.35,5 + 0,012.96 = 3,792 gam

Ta có: \(n_{H_2}=\dfrac{0,5376}{22,4}=0,024\left(mol\right)\)
\(n_{OH^-}=2n_{H_2}=0,048\left(mol\right)\)
Gọi: \(\left\{{}\begin{matrix}n_{H_2SO_4}=x\left(mol\right)\\n_{HCl}=2x\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H^+}=2n_{H_2SO_4}+n_{HCl}=2x+2x=4x\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow4x=0,048\Rightarrow x=0,012\left(mol\right)\)
⇒ nSO42- = nH2SO4 = 0,012 (mol)
nCl- = nHCl = 0,024 (mol)
⇒ m muối = mKL + mSO42- + mCl- = 1,788 + 0,012.96 + 0,024.35,5 = 3,792 (g)

đáp án B
Ta có nH2=0.24 nên nOH-=0.48 toàn bộ OH- phản ứng với H+ được thay bằng các gốc axit tạo muối nên nH+ của H2SO4=2/(2+4) *0.24=0.08
nên nSO4=0.04,n Cl=0.16
=> m muôi=17.88+0.04*96+0.16*35.5=27.4

Gọi nM = x; nA = y; nB = z. M + 2H20 --> M(0H)2 + H2
x...........................x............
A + H20 --> A0H + 1/2H2 y.........................y........y/2
B + H20 --> B0H + 1/2H2 z......................z........z/2
Tổng n OH- là : 2x + y + z
1/2 dung dịch C thì chứa x + y/2 + z/2 mol 0H- chính bằng nH2 = 0,24 mol Ta có : H(+) + 0H(-) --->H20
0,24......0,24
=> tổng nH+ phải dùng là 0,24 mol (1)
mà số phân tử gam HCl nhiều gấp 4 lần số phân tử gam H2SO4. tức nHCl = 4nH2S04 nhưng trong phân tử H2S04 có 2H+
=> nH+ trong HCl = 2 nH+ trong H2S04 (2)
từ 1 và 2 => n H+ trong HCl =n Cl- = nHCl = 0,16 n H+ trong H2S04 = 2nS04(2-) =0,08
m muối = m kim loại + m Cl- + m S04(2-)
= 17,88/2 + 0,08*35,5 + 98*(0,08/2)
= 18,46 g
=> Đáp án D