cho 31,4g hỗn hợp gồm NaHSO3và Na2CO3vào 400g dung dịch H2SO4 9,8% đun nóng để phản ứng hoàn toàn thu đc hỗn hợp khí A có tỉ khối hơi so với H2 là 28,66 và dung dịch X . tính C% các chất trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(2Al+3S\underrightarrow{^{t^o}}Al_2S_3\)
Gọi số mol Al là x; S là y.
Ta có phương trình : \(27x+32y=10,2\left(g\right)\)
Vì cho Y tác dụng với HCl thu được hỗn hợp khí nên Al dư
\(\Rightarrow n_{Al_2S_3}=\dfrac{1}{3}n_S=\dfrac{y}{3}\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=x-\dfrac{2y}{3}\left(mol\right)\)
PTHH:
\(Al_2S_3+6HCl\rightarrow2AlCl_3+3H_2S\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{H2S}=3n_{Al2S3}=y\left(mol\right);n_{H2}=\dfrac{3}{2}n_{Al}=1,5x-y\left(mol\right)\)
\(M_Z=18\)
Áp dụng quy tắc đường chéo :
\(\Rightarrow\dfrac{n_{H2S}}{n_{H2}}=\dfrac{16}{16}\Rightarrow1,5x-y=y\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{10,2}=52,94\%\\\%m_S=100\%-52,94\%=47,06\%\end{matrix}\right.\)

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
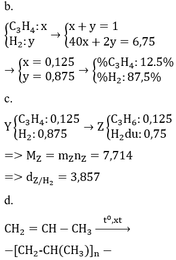


Ta có:
n H2 = 0,05 ( mol )
1.PTHH
Fe + H2SO4 ====> FeSO4 + H2
FeO + H2SO4 ====> FeSO4 + H2O
theo pthh: n Fe = n H2 = 0,05 ( mol )
=> m Fe = 2,8 ( g )
=> m FeO = 7,2 ( g ) => n FeO = 0,1 ( mol )
2.
theo pthh: n H2SO4 = 0,05 + 0,1 = 0,15
=> m H2SO4 = 14,7 ( g )
=> m dd H2SO4 9,8% = 150 ( g )

Đáp án A
V = 5,04l => n = 0,225 mol
n(C2H2) = x
n(H2) = y
m= 26x + 2y
28,5 = (26x+2y)/x
x+y = 0,225
=> x = 0,1mol
y= 0,125 mol
n(liên kết pi) = 0,2 mol
=> n(Br2) = 0,2 - 0,125 = 0,075 mol

Đáp án A
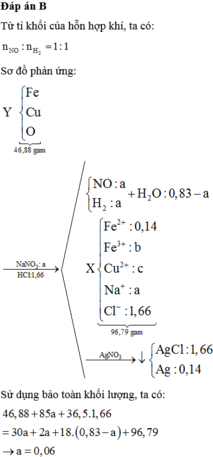
*Bài toán phụ: NaOH xử lí dung dịch sau phản ứng!
Giả sử có 19x mol H2SO4 → số mol NaNO3 là x mol.

Ø Bài này chỉ nằm ở vấn đề H+ còn dư sau phản ứng hay không? Thực sự đạt được điểm câu này hay không phụ thuộc vào “may mắn” là bạn nghĩ rồi xét trường hợp nào trước. Thật vậy???
*Khi xét trường hợp H+ còn:


Vậy đáp án nào đúng? Hay cả hai đều đúng.! Rõ là TH sau chắc chắn đúng rồi (vì giải chi tiết đến cuối).
Còn TH đầu thì sao? Nếu giải tiếp, liệu các số liệu tiếp còn ổn? vậy, cùng giải tiếp TH đầu:
Bảo toàn C có 0,08 mol MgCO 3 số mol Al2O3 còn lại 0,0344 mol (số liệu gần bằng).
Bảo toàn điện tích có số mol H + dư = 0,19x2 – 0,02x3 – 0,08x2 – 0,0344x6 – 0,01=-0,0564mol?
ồ, vậy là đến đây, số liệu đã chứng tỏ không phù hợp.! Vậy, chọn đáp án A là đáp án cuối cùng.
*Nhận xét: Một bài tập thực sự khó!

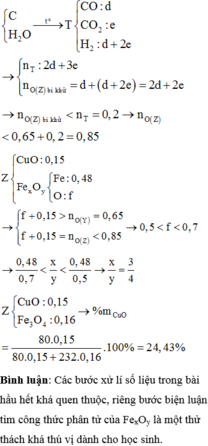
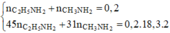
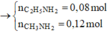





Gọi số mol của CO2; SO2 lần lược là a, b. Ta có:
\(\dfrac{44a+64b}{a+b}=28,66.2=57,32\)
\(\Leftrightarrow333a-167b=0\)
\(\Leftrightarrow b=2a\)
Ta có:
\(m_{H_2SO_4}=400.9,8\%=39,2\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\)
Nếu hỗn hợp muối chỉ có NaHSO3
\(\Rightarrow n_{NaHSO_3}=\dfrac{31,4}{104}=0,302\)
2NaHSO3(0,302) + H2SO4(0,151) --> Na2SO4 + 2SO2 + 2H2O
Ta thấy 0,151 < 0,4
Tương tự với trường hợp hỗn hợp chỉ có Na2CO3.
Ta suy ra được axit dư. Hỗn hợp kim loại hết.
PTHH:
2NaHSO3(2a) + H2SO4(a) --> Na2SO4(a) + 2SO2(2a) + 2H2O
Na2CO3(a) + H2SO4(a) --> Na2SO4(a) + CO2(a) + H2O
\(\Rightarrow208a+106a=31,4\)
\(\Leftrightarrow a=0,1\)
\(\Rightarrow m_{CO_2}=0,1.44=4,4\)
\(\Rightarrow m_{SO_2}=0,1.2.64=12,8\)
\(\Rightarrow m_X=31,4+400-4,4-12,8=414,2\)\(\Rightarrow n_{Na_2SO_4}=2.0,1=0,2\)\(\Rightarrow m_{Na_2SO_4}=0,2.142=28,4\)\(\Rightarrow C\%_{Na_2SO_4}=\dfrac{28,4.100\%}{414,2}=6,86\%\)\(\Rightarrow n_{H_2SO_4\left(pu\right)}=2.0,1=0,2\)\(\Rightarrow n_{H_2SO_4\left(du\right)}=0,4-0,2=0,2\)\(\Rightarrow m_{H_2SO_4\left(du\right)}=0,2.98=19,6\)\(\Rightarrow C\%_{H_2SO_4}=\dfrac{19,6.100\%}{414,2}=4,73\%\)
Theo đề bài ta có : \(\left\{{}\begin{matrix}nH2SO4=\dfrac{400.9,8}{100.98}=0,4\left(mol\right)\\M_A=28,66.2=57,32\left(\dfrac{g}{mol}\right)\end{matrix}\right.\)
Gọi x ,y lần lượt là số mol của NaHSO3 và Na2CO3
Ta có PTHH :
\(\left(1\right)2NaHSO3+H2SO4->Na2SO4+2H2O+SO2\uparrow\)
x mol........................................1/2x mol........................x mol
\(\left(2\right)Na2CO3+H2SO4->Na2SO4+H2O+CO2\uparrow\)
y mol.........................................y mol............................ y mol
Theo đề bài ta có PT : \(104x+106y=31,4\left(1\right)\)
Hỗn hợp khí thu được bao gồm SO2 và CO2
ta có sơ đồ đường chéo sau :
=> \(\dfrac{x}{y}=\dfrac{167}{333}=>y=\dfrac{333}{167}x\left(2\right)\)
Thay (2) vào (1) ta được :
\(104x+106.\dfrac{167}{333}x=31,4=>x\approx0,2;y\approx0,1\)
=> nNa2SO4 = 1/2x + y = 0,1 + 0,1 = 0,2 (mol)
=> \(C\%_{Na2SO4}=\dfrac{0,2.98}{31,4+400}.100\%\approx4,543\%\)
p/s : số liệu có chính xác ko chứ thấy số mol lẻ quá ~~