hòa tan 2.84g hỗn hợp 2 muối CaCO3 và MgCO3 bằng dd HCl dư thu được 0.672 lít khí CO2 (đktc). TÍnh thành phần % số mol mỗi muối trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nCO2=6,72/22,4=0,03(mol)
pt ion:
H++CO32---------->HCO3-
------0,03---------0,03
Do HCl dư => H+ dư, tiếp tục xảy ra phản ứng:
H++HCO3----------->CO2+H2O
-----0,03---------0,03
Gọi số mol CaCO3 là x=>nCO32-=nCaCO3=x mol
MgCO3 là y=>nCO32-=nMgCO3=y mol
=>\(\Sigma\)nCO3=x+y (mol)
Mặt khác:
mCaCO3+mMgCO3=2,84 nên ta có hệ pt:
\(\left\{{}\begin{matrix}x+y=0,03\\100x+84y=2,84\end{matrix}\right.\)
<=>\(\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
Còn lại bạn tự tình đi cho quen
Chúc bạn học tốt! Thân

CaCO3 + H2SO4 --> CaSO4 + CO2 + H2O
x x x
MgCO3 + H2SO4 --> MgSO4 + CO2 + H2O
y y y
nCO2=\(\dfrac{0,896}{22,4}\)=0,04
100x+84y=3,68
x+y=0,04
\(\left\{{}\begin{matrix}x=0,02\\y=0,02\end{matrix}\right.\)
%mCaCO3=\(\dfrac{0,02.100}{3,68}\)=54,35%
%mMgCO3=100-54,35=45,65%
mCaSO4=0,02.136=2,72g
mMgSO4=0,02.120=2,4g

MgCO3 ----> MgO + CO2
CaCO3 -----> CaO + CO2
0,15 (mol) <------------ 0,15 (mol) (1) đây ý nói là tổng lượng mol CO2 = tổng lượng hỗn hợp muối
MgCO3 + HCl -------> MgCl2 + CO2 + H20
CaCO3 + HCl --------> CaCl2 + CO2 + H20
=> n(MgCO3,CaCO3) = n(MgCl2,CaCl2) = 0,15 (mol)
=> M(MgCl2,CaCl2) = 317/3
Sau đó, ta đặt: C (là phần trăm của CaCl2 trong hỗn hợp muối)
1-C (là phần trăm của MgCl2 trong hỗn hợp muối)
Với C là 100% trong hỗn hợp đó
=> 111C + 95x(1-C) = 317/3
Từ đó suy ra: C= 2/3
Vì lượng muối trong hỗn hợp tác dụng với HCl bằng lượng từng muối trong hỗn hợp ban đầu nên
%CaCO3 = 2/3x100% = 66,667%
%MgCO3 = 1/3x100% = 33,33%

Ta có: \(n_{CO_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
a. PTHH:
\(MgCO_3+H_2SO_4--->MgSO_4+H_2O+CO_2\)
\(MgSO_4+H_2SO_4--\times-->\)
b. Theo PT: \(n_{MgCO_3}=n_{CO_2}=0,03\left(mol\right)\)
\(\Rightarrow m_{MgCO_3}=0,03.84=2,52\left(g\right)\)
\(\Rightarrow m_{MgSO_4}=6-2,52=3,48\left(g\right)\)
\(\Rightarrow\%_{m_{MgCO_3}}=\dfrac{2,52}{6}.100\%=42\%\)
\(\%_{m_{MgSO_4}}=100\%-42\%=58\%\)
c. Theo PT: \(n_{MgSO_4}=n_{CO_2}=0,03\left(mol\right)\)
\(\Rightarrow m_{MgSO_4}=0,03.120=3,6\left(g\right)\)
\(\Rightarrow m_{MgSO_{4_{thu.được.sau.phản.ứng}}}=3,6+3,48=7,08\left(g\right)\)

Chọn D
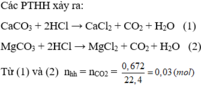
Gọi x là thành phần % số mol của CaC O 3 trong hỗn hợp thì (1 - x) là thành phần % số mol của MgC O 3
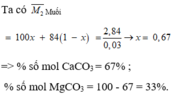

a)
Gọi $n_{CaCO_3} = a; n_{MgCO_3} = b$
$\Rightarrow 100a + 84b = 28,4(1)$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$n_{CO_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{CaCO_3} = \dfrac{0,2.100}{28,4}.100\% = 70,42\%$
$\%m_{MgCO_3} = 100\% -70,42\% = 29,58\%$
b)
$n_{HCl\ pư} = 2n_{CO_2} = 0,6(mol)$
$n_{HCl\ dư} = 0,6.1\% = 0,006(mol)$
$n_{HCl\ đã\ dùng} = 0,6 + 0,006 = 0,606(mol)$
$m_{dd\ HCl} = \dfrac{0,606.36,5}{29,2\%} = 75,75(gam)$
$V_{dd\ HCl} = \dfrac{75,75}{1,25} = 60,6(ml)$


Gọi x là số mol CaCO3
Gọi y là số mol MgCO3
PTHH: CaCO3 +2HCl -> CaCl2 +CO2+H2O(1)
xmol xmol
MgCO3 +2HCl -> MgCl2 +CO2+H2O(2)
ymol ymol
Theo đề ra và theo PT1,2 ta có hệ Pt:
100x +84y= 2,84 *
x+y =0,672/22,4
Giải hệ Pt, tìm x= 0,02= nCaCO3;
y=0,01= nMgCO3
%nCaCO3= 0,02/0,03.100%=67%
%nMgCO3= 33%
Mình xin lỗi nha bài toán yêu cầu tìm thành phần % số mol mỗi muối trong hỗn hợp mà mình nhầm
=> %nCaCO3 = \(\dfrac{0,02}{0,03}\) . 100 \(\approx\) 66,67%
=> %nMgCO3 = 100 - 66,67 = 33,33 %