Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A

Giải thích:
Zn + 2HCl -> ZnCl2 + H2
ZnO + 2HCl -> ZnCl2 + H2O
nH2 = nZn = 0,4 mol
nHCl = 1,2 mol = 2nZn + 2nZnO => nZnO = 0,2 mol
=> %mZnO = 38,4%
Đáp án B

Chọn đáp án C
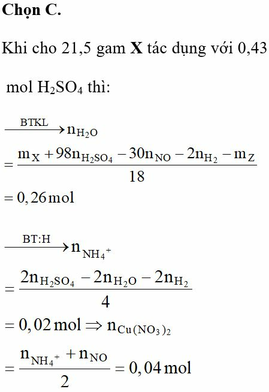
- Khi cho 21,5 gam X tác dụng với 0,43 mol H2SO4 thì:
![]()
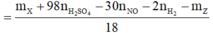
= 0,26 mol


= 0,04 mol
- Ta có
![]()

- Xét hỗn hợp X ta có:
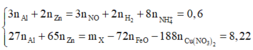
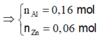
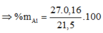
= 20,09

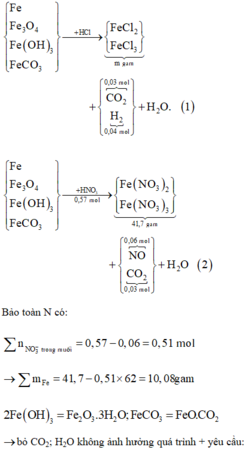
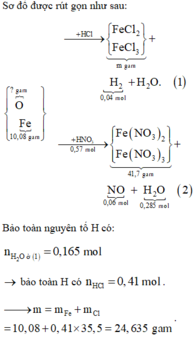
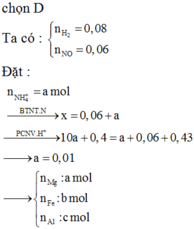


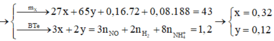
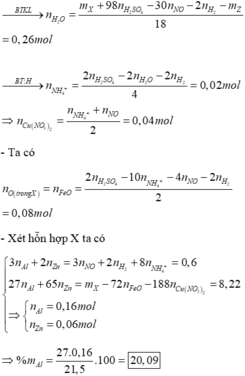
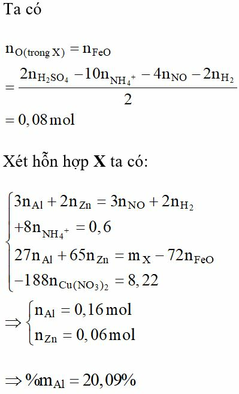
Đáp án A
Tại sao lại là 197.(100-a) đấy ạ