Một muối ngậm nước có công thức là CaSO4.nH2O. Biết 19,11 gam mẫu chất có chứa 4 gam nước. Hãy xác định công thức phân tử của muối ngậm nước trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mCaSO4=19,11-4=15,11g
=>nCaSO4=15,11/136(mol)
nH2O=4/18 (mol)
Công thức là CaSO4:nH2O
=>1:n=nCaSO4:nH2O=1:2
=> CaSO4.2H2O

Cứ 136 + 18n (g) CaSO4.nH2O thì có 18n (g) H2O
Mà 19,11g CaSO4.nH2O có 4g H2O
=> \(\frac{136+18n}{19,11}=\frac{18n}{4}\)
=> 72n + 544= 343,98n
=> n=2
=>CTHH: CaSO4.2H2O

a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)

Đặt CTPT của muối cacbonat ngậm nước là:

Vậy CTPT của muối cacbonat ngậm nước là Na 2 CO 3 . H 2 O
Đáp án: A

Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
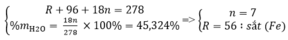
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O

có mFe/Mx=0.20144
\(\Rightarrow\) Mx=278 rồi tính được n=7
ct FeSO4.7H20

Bài 1:
Gọi công thức tổng quát của hợp chất tạo bởi 2 nguyên tố A(II) và O là AO.
Theo đề bài, ta có:
\(\%m_O=20\%\\ =>\%m_A=100\%-20\%=80\%\)
=> \(\dfrac{\%m_O}{\%m_A}=\dfrac{20}{80}\\ < =>\dfrac{16}{M_A}=\dfrac{20}{80}\\ =>M_A=\dfrac{16.80}{20}=64\left(\dfrac{g}{mol}\right)\)
Vậy: Nguyên tố A(II) cần tìm là đồng (Cu=64).

Theo đầu bài ta có tỷ lệ :
\(\dfrac{M_{CaSO4.nH2O}}{m_{CaSO4.nH2O}}=\dfrac{M_{H2O}}{m_{H2O}}=\dfrac{136+18n}{19,11}=\dfrac{18n}{4}\)
=> 544 + 72n = 343,98n
=> n = 2
Vậy công thức hóa học của muối là CaSO4.2H2O
làm sao tính ra 2 đx z bạn