phân tích 273g hỗn hợp muối KClO3 và KMnO4 ta thu được 49.27l oxi (đktc)
a,Viết phương trình hóa học phản ứng
b, Tính thành phần % khối lượng của các chất có trong hỗn hợp muối
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, Gọi: \(\left\{{}\begin{matrix}n_{KClO_3}=x\left(mol\right)\\n_{KMnO_4}=y\left(mol\right)\end{matrix}\right.\) ⇒ 122,5x + 158y = 43,85 (1)
Ta có: \(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}+\dfrac{1}{2}n_{KMnO_4}=\dfrac{3}{2}x+\dfrac{1}{2}y=0,25\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,1.122,5}{43,85}.100\%\approx27,94\%\\\%m_{KMnO_4}\approx72,06\%\end{matrix}\right.\)

nH2 \(\approx\)0,2 (mol)
Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
0,2 <------------ 0,2 <----- 0,2 (mol)
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
b) %mMg = \(\frac{0,2.24}{8,8}\) . 100% =54,55%
%mMgO = 45,45%
c) mMgO = 8,8 - 0,2 . 24 = 4(g)
=> nMgO=0,1 (mol)
Theo pt(2) nMgCl2 = nMg = 0,1 (mol)
=> \(\Sigma n_{MgCl_2}\) = 0,2 + 0,1 = 0,3 (mol)
mmuối = 0,3 . 95 = 28,5 (g)

1. Phương trình hoá học của các phản ứng:
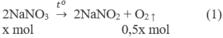
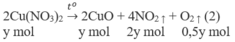
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
![]()
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%

1)
Gọi số mol KMnO4, KClO3 là a, b (mol)
=> 158a + 122,5b = 308,2 (1)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
a-------------------------------->0,5a
2KClO3 --to--> 2KCl + 3O2
b------------------>1,5b
=> mO2 = (0,5a + 1,5b).32 = 16a + 48b (g)
mD = 308,2 - 16a - 48b(g)
\(m_{Mn}=\dfrac{\left(308,2-16a-48b\right).10,69}{100}=32,94658-1,7104a-5,1312b\left(g\right)\)
=> \(n_{Mn}=\dfrac{32,94658-1,7104a-5,1312b}{55}=0,6-\dfrac{1069}{34375}a-\dfrac{3207}{34375}\left(mol\right)\)
Mà \(n_{Mn}=n_{KMnO_4}=a\left(mol\right)\)
=> \(\dfrac{35444}{34375}a+\dfrac{3207}{34375}b=0,6\) (2)
(1)(2) => a = 0,4 (mol); b = 2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{KMnO_4}=\dfrac{0,4.158}{308,2}.100\%=20,506\%\\\%m_{KClO_3}=\dfrac{2.122,5}{308,2}.100\%=79,494\%\end{matrix}\right.\)
2)
Giả sử nung 100 (g) đá vôi
=> \(m_{CaCO_3\left(bđ\right)}=\dfrac{80.100}{100}=80\left(g\right)\)
\(m_{rắn.sau.pư}=\dfrac{100.73,6}{100}=73,6\left(g\right)\)
=> mCO2 = 100 - 73,6 = 26,4 (g)
\(n_{CO_2}=\dfrac{26,4}{44}=0,6\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
0,6<----------------0,6
=> mCaCO3(pư) = 0,6.100 = 60 (g)
\(H\%=\dfrac{60}{80}.100\%=75\%\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a.
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b.
\(n_{Mg}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right),m_{CuO}=12-2,4=9,6\left(g\right)\)
c.
\(m_{muối}=m_{CuCl_2}+m_{MgCl_2}=0,12.135+95.0,1=25,7\left(g\right)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{HCl}=0,5.0,2=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{HCl\left(pư\right)}=2n_{H_2}=0,08\left(mol\right)< 0,1\left(mol\right)\)
→ HCl dư.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=x+y=0,04\left(1\right)\)
\(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=x\left(mol\right)\\n_{FeCl_2}=n_{Fe}=y\left(mol\right)\end{matrix}\right.\)⇒ 136x + 127y = 5,26 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,02.65}{0,02.65+0,02.56}.100\%\approx53,72\%\\\%m_{Fe}\approx46,28\%\end{matrix}\right.\)
phân tích 273g hỗn hợp muối KClO3 và KMnO4 ta thu được 49.27l oxi (đktc)
a,Viết phương trình hóa học phản ứng
b, Tính thành phần % khối lượng của các chất có trong hỗn hợp muối
\(a) PTHH:\)
\(2KClO3 -(nhiệt)-> 2KCl + 3O2\) (1)
\(2KMnO4 -(nhiệt)-> K2MnO4 + MnO2 +O2\)(2)
\(b)\)
Đặt a là nKClO3, b là nKMnO4
Ta có: 122,5a 158b
Ta có: \(122,5a + 158b = 273 \) (I)
nO2 thu được = \(\dfrac {49,27} {22,4}\)= \(2,1995 (mol) \)
Theo (1) và (2): \(1,5a + 0,5b = 2,1995\) (II)
Giai hệ (I) và (II), \(\begin{cases} a=1,2 \\ b = 0,8 \end{cases}\)
%mKClO3 = \(\frac{1,2.122,5.100}{273}\) = 53,85%
=> %mKMnO4 = 100% - 53,85% = 46,15%
PTHH: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\left(1\right)\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\left(2\right)\)
\(n_{O_2}=\dfrac{49,27}{22,4}=\dfrac{4927}{2240}\left(mol\right)\)
Đặt số mol KClO3 là x, số mol KMnO4 là y, ta có hệ:
\(\left\{{}\begin{matrix}122,5x+158y=273\\1,5x+0,5y=\dfrac{4927}{2240}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=1,200736639\\y=0,7968972262\end{matrix}\right.\)
\(m_{KClO_3}=1,200736639.122,5=147,0902383\left(g\right)\)
\(m_{KMnO_4}=273-147,0902383=125,9097617\left(g\right)\)
\(\%KClO_3=\dfrac{147,0902383}{273}.100\%=53,88\%\)
\(\%KMnO_4=100\%-53,88\%=46,12\%\)