Cho 1,68 gam một kim loại hóa trị II tác dụng với một lượng dư dung dịch HCl. Sau khi phản ứng xong nhận thấy khối lượng dung dịch sau phản ứng nặng hơn khối lượng dung dịch ban đầu 1,54 gam. Xác định CTHH kim loại đã cho.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi CT của kl hóa trị II là A
\(m_{H_2}=1,68-1,54=0,14g\)\(\Rightarrow n_{H_2}=0,7mol\)
pthh: \(A+2HCl\rightarrow ACl_2+H_2\)
____\(M_A\left(g\right)\)_____________1 mol
____\(1,68g\)______________0,07mol
\(\Rightarrow M_A=24\)
=> A là Mg.

Gọi kim loại có hóa trị II cần tìm là R
Ta có PTHH :
\(R+2HCl->RCl2+H2\uparrow\)
a) Theo đề ta có :
\(\Delta m\left(t\text{ă}ng\right)=15,75\left(g\right)\)
=> mH2 = 16,25 - 15,75 = 0,5 (g) => nH2 = \(\dfrac{0,5}{2}=0,25\left(moL\right)\)
Theo PTHH ta có : nR = nH2 = 0,25 (mol)
=> \(M_R=\dfrac{16,25}{0,25}=65\left(\dfrac{g}{mol}\right)\left(nh\text{ận}\right)\left(Zn=65\right)\)
=> Kim loại có hóa trị II cần tìm là Kẽm (Zn)
b) Đề thiếu ????

Bài 1
2Al+3CuSO4→Al2(SO4)3+3Cu
a-------------------------------------1,5a
Đặt a là số mol của Al pư
Độ tăng của thanh Al sau khi lấy thanh ra khỏi dd:
46,38−45=1,38(g)
⇒96a−27a=69a=1,38
⇒a=0,02⇒a=0,02
⇒mCu=1,92(g)
Câu 1:
2Al + 3Cu2+ --> 2Al3+ + 3Cu
x............1,5x.........................1,5x
m sau – m trước = 64 . 1,5x – 27x = 46,38 – 45
=> x = 0,02 => m Cu phản ứng = 1,5 . 0,02 . 64 = 1,92g
Câu 2:
mAgNO3 = 340 . 6% = 20,4g => nAgNO3 = 0,12mol
Khối lượng AgNO3 giảm 25% chính là lượng AgNO3 phản ứng
=> nAgNO3 phản ứng = 0,12 . 25% = 0,03
Cu + 2AgNO3 ---> Cu(NO3)2 + 2Ag
0,015..........0,03.....................................0,03
m vật = 15 + (0,03.108 - 0,015.64) = 17,28 (g)

a)
Gọi số mol R là a (mol)
PTHH: 2R + nH2SO4 --> R2(SO4)n + nH2
a------------------------->0,5an
mtăng = mR - mH2 = a.MR - 2.0,5an = a.MR - an = 1,2 (1)
PTHH: 4R + nO2 --to--> 2R2On
a--------------->0,5a
=> \(0,5a\left(2.M_R+16n\right)=2,55\)
=> a.MR + 8an = 2,55 (2)
(1)(2) => a.MR = 1,35; an = 0,15
=> \(M_R=9n\left(g/mol\right)\)
Xét n = 3 thỏa mãn => MR = 27 (g/mol)
=> R là Al
a = 0,05 (mol)
m = 1,35 (g)
b)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
=> VO2 = 0,0375.22,4 = 0,84 (l)
=> Vkk = 0,84 : 20% = 4,2 (l)

Bài1
M+2HCl---.MCl2+H2
n\(_M=\frac{13}{M}\),,,,n\(_{MCl2}=\frac{27,2}{M+71}\)
Theo pthh
n\(_M=n_{MCl2}\rightarrow\frac{13}{M}=\frac{27,2}{M+71}\)
=> 13M+932=27,2M
=>932=14,2M
=>M=56
=> M là Zn
Bài 2 xem lại đề
Bài 1:
Gọi kim loại đó là A ta có:
\(\text{PTHH: A + 2HCl → ACl2 + H2 ↑}\)
Số mol của A tính theo khối lượng là: 13 : MA (mol)
\(\text{Số mol của muối là: 27,2 : ( MA + 71 ) (mol)}\)
Số mol của A tính theo pt bằng số mol của muối
\(\text{\Rightarrow13MA=27,2MA+71}\Rightarrow\text{MA=65 }\Rightarrow\text{A là: Zn (Kẽm)}\)
Bài 2
2Gọi CT của kl hóa trị II là A
\(\text{mH2=1,68−1,54=0,14g}\Rightarrow\text{nH2=0,7mol}\)
\(\text{pthh: A+2HCl→ACl2+H2}\)
\(\text{____MA(g)_____________1 mol}\)
\(\text{____1,68g______________0,07mol }\)
\(\Rightarrow\text{MA=24}\Rightarrow\text{A là Mg}\)

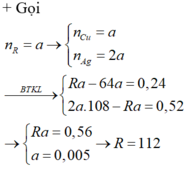
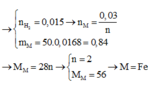
Lời giải:
Gọi kim loại hóa trị II là R
PTHH: R + 2HCl ===> RCl2 + H2
Do khối lượng dung dịch sau phản ứng nặng hơn khối lượng dung dịch thu được là 1,54 (gam)
=> mH2(thoát ra) = \(1,68-1,54=0,14 (gam)\)
=> nH2 = \(\frac{0,14}{2}=0,07\left(mol\right)\)
Theo phương trình, nR = 0,07 (mol)
=> MR = \(1,68\div0,07=24\left(\frac{g}{mol}\right)\)
Vậy kim loại đó là Magie (Mg)