Dẫn từ từ V lít khí CO2 (đktc) vào 300ml dd chứa Ba(OH)2 0,5M và NaOH 1M thì thu được 19,7 g kết tủa trắng. Tính thể tích V.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{Ba\left(OH\right)_2}=0,5.1=0,5\left(mol\right)\)
\(n_{KOH}=0,5.2=1\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{39,4}{197}=0,2\left(mol\right)\)
TH1: Kết tủa chưa bị hòa tan.
PT: \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
_____0,2_________________0,2 (mol)
\(\Rightarrow V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
TH2: Kết tủa đã bị hòa tan 1 phần.
PT: \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
_____0,5______0,5________0,5 (mol)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
0,5________1________0,5 (mol)
\(CO_2+H_2O+K_2CO_3\rightarrow2KHCO_3\)
0,5_____________0,5 (mol)
\(CO_2+BaCO_3+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
0,3________0,3 (mol)
\(\Rightarrow V_{CO_2}=\left(0,5+0,5+0,5+0,3\right).22,4=40,32\left(l\right)\)
\(n_{Ba\left(OH\right)_2}=0,5.1=0,5\left(mol\right)\)
\(n_{KOH}=2.0,5=1\left(mol\right)\)
\(n_{Ba_2CO_3}=\dfrac{39,4}{137}\left(mol\right)\)
PTHH :
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
39,4/137 39,4/137 39,4/137
Ba(OH)2 dư nên không phản ứng tiếp .
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
1 0,5
\(V_{CO_2}=\left(\dfrac{197}{685}+0,5\right).22,4\approx17,64\left(l\right)\)

Đáp án D
Lượng CO 2 tham gia phản ứng và lượng Ba ( OH ) 2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra :
n CO 2 = 2 n Ba ( OH ) 2 - n BaCO 3 = ( 2 a - 0 , 1 ) mol
Đồ thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO 2 ở TN1 và TN2 :
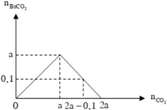
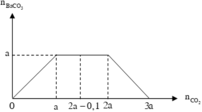
Dựa vào 2 đồ thị, ta thấy a < 2a - 0,1 < 2a nên ở TN2 kết tủa đạt cực đại. Suy ra :
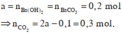
Vậy V = 6,72 lít và a = 0,2 mol

\(\left\{{}\begin{matrix}n_{Ba\left(OH\right)_2}=0,1.0,3=0,03\left(mol\right)\\n_{KOH}=0,2.0,3=0,06\left(mol\right)\end{matrix}\right.\)
\(n_{BaCO_3}=\dfrac{5,91}{197}=0,03\left(mol\right)\)
Do nBaCO3 = nBa(OH)2 => Ba2+ bị kết tủa hết
PTHH:
(1) Ba(OH)2 + CO2 --> BaCO3 + H2O
(2) 2NaOH + CO2 --> Na2CO3 + H2O
(3) Na2CO3 + CO2 + H2O --> 2NaHCO3
- Nếu CO2 chỉ tham gia vào pư (1)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
0,03<---0,03
=> nCO2(min) = 0,03 (mol) (*)
- Nếu CO2 tham gia vào pư (1), (2), (3)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
0,03----->0,03----->0,03
2NaOH + CO2 --> Na2CO3 + H2O
0,06--->0,03------>0,03
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,03---->0,03
=> nCO2(max) = 0,09 (mol) (**)
(*)(**) => \(0,03\le n_{CO_2}\le0,09\)
=> \(0,672\le V\le2,016\)

Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

\(n_{Ca\left(OH\right)_2}=0,32\left(mol\right)\)
\(n_{KOH}=0,6\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{10}{100}=0,1\left(mol\right)\)
PTHH :
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
0,1 0,32 0,1
Ca(OH)2 dư nên tính theo CaCO3
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
0,3 0,6
\(V_{CO_2}=\left(0,1+0,3\right).22,4=8,96\left(l\right)\)

Đáp án A
n B a ( O H ) 2 = 0,2 mol; nNaOH = 0,2 mol
n O H - = 0,6 mol; n B a C O 3 =19,7/197 = 0,1 mol
Ta có 2 trường hợp:
-TH1: CO2 tác dụng với OH- chỉ tạo CO32-
CO2 + 2OH- → CO32- + H2O
0,1 0,2← 0,1 mol
Ba2+ + CO32- → BaCO3↓
0,2 0,1 ← 0,1 mol
→ V C O 2 = 2,24 lít
-TH2: CO2 tác dụng với OH- tạo CO32- và HCO3-
CO2 + OH- → HCO3-
0,4 ← (0,6-0,2) mol
CO2 + 2OH- → CO32- + H2O
0,1 0,2 ← 0,1
Ba2+ + CO32- → BaCO3↓
0,2 0,1 ← 0,1 mol
Ta có: n C O 2 = 0,1+ 0,4 = 0,5 mol → V C O 2 = 11,2 lít

Đáp án D
Ta có:
nBa(OH)2= 0,2.1= 0,2 mol;
nNaOH= 0,2.1= 0,2 mol;
nBaCO3= 19,7/197= 0,1 mol
nOH-= 0,2.2 + 0,2= 0,6 mol; nBa2+= 0,2 mol
Do đề hỏi giá trị lớn nhất của V nên số mol CO2 phải lớn nhất. Khi đó xảy ra 2 PT sau:
CO2+ 2OH- → CO32-+ H2O (1)
0,1 0,2 ← 0,1 mol
CO2+ OH- → HCO3- (2)
0,4← (0,6-0,2)
Ba2++ CO32- → BaCO3 (3)
0,2 0,1 ← 0,1 mol
Theo PT (1), (2) ta có: nCO2= 0,1 + 0,4= 0,5 mol
→ VCO2= 0,5.22,4= 11,2 lít


nBa(OH)2= 0,15 (mol)
nNaOH= 0,3 (mol)
nBaCO3 = 0,1 (mol)
Các pt xảy ra theo thứ tự:
Ba(OH)2 + CO2 \(\rightarrow\) BaCO3 + H2O (1)
2NaOH + CO2 \(\rightarrow\) Na2CO3 + H2O (2)
nếu CO2 dư:
Na2CO3 + CO2 + H2O \(\rightarrow\) 2NaHCO3 (3)
BaCO3 + CO2 + H2O \(\rightarrow\) Ba(HCO3)2 (4)
+ TH1: CO2 pư vừa đủ với dd hh bazơ
Theo pt(1) nBaCO3 = nBa(OH)2 = 0,15 \(\ne\) 0,1 (mol) (loại)
+ TH2: CO2 pư thiếu so với dd hh bazơ \(\Rightarrow\) xảy ra pt (1)
Theo pt(1) nCO2 = nBaCO3= 0,1 (mol)
VCO2= 0,1 . 22,4 = 2,24 (l)
+ TH3: CO2 pư dư so với dd hh bazơ \(\Rightarrow\) xảy ra pt(1), (2), (3), (4)
Ba(OH)2 + CO2 \(\rightarrow\) BaCO3 \(\downarrow\) + H2O
0,15 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15 (mol)
2NaOH + CO2 \(\rightarrow\) Na2CO3 + H2O
0,3 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15 (mol)
Na2CO3 + CO2 + H2O \(\rightarrow\) 2NaHCO3
0,15 \(\rightarrow\) 0,15 (mol)
BaCO3 + CO2 + H2O \(\rightarrow\) Ba(HCO3)2
(0,15 - 0,1) \(\rightarrow\) 0,05 (mol)
VCO2 = (0,15 + 0,15 + 0,15 + 0,05).22,4= 11,2 (l)
nBa(OH)2= 0,15 (mol)
nNaOH= 0,3 (mol)
nBaCO3 = 0,1 (mol)
Các pt xảy ra theo thứ tự:
Ba(OH)2 + CO2 →→ BaCO3 + H2O (1)
2NaOH + CO2 →→ Na2CO3 + H2O (2)
nếu CO2 dư:
Na2CO3 + CO2 + H2O →→ 2NaHCO3 (3)
BaCO3 + CO2 + H2O →→ Ba(HCO3)2 (4)
+ TH1: CO2 pư vừa đủ với dd hh bazơ
Theo pt(1) nBaCO3 = nBa(OH)2 = 0,15 ≠≠ 0,1 (mol) (loại)
+ TH2: CO2 pư thiếu so với dd hh bazơ ⇒⇒ xảy ra pt (1)
Theo pt(1) nCO2 = nBaCO3= 0,1 (mol)
VCO2= 0,1 . 22,4 = 2,24 (l)
+ TH3: CO2 pư dư so với dd hh bazơ ⇒⇒ xảy ra pt(1), (2), (3), (4)
Ba(OH)2 + CO2 →→ BaCO3 ↓↓ + H2O
0,15 →→ 0,15 →→ 0,15 (mol)
2NaOH + CO2 →→ Na2CO3 + H2O
0,3 →→ 0,15 →→ 0,15 (mol)
Na2CO3 + CO2 + H2O →→ 2NaHCO3
0,15 →→ 0,15 (mol)
BaCO3 + CO2 + H2O →→ Ba(HCO3)2
(0,15 - 0,1) →→ 0,05 (mol)
VCO2 = (0,15 + 0,15 + 0,15 + 0,05).22,4= 11,2 (l)