nung nóng hỗn hợp 5,4g bột nhôm(Al) và 6,4g bột lưu huỳnh trong ống kín
a/ hỏi sau phản ứng còn dư chất nào bao nhiêu gam
b/ tính khối lượng Al2S3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: 2Al + 3S ===> Al2S3
=> nAl = 8,1 / 27 = 0,3 mol
=> nS = 9,6 / 32 = 0,3 mol
Lập tỉ lệ ===> Al dư, S hết
=> nAl(pứ) = 0,2 mol
=> mAl(pứ) = 0,2 x 27 = 5,4 gam
Áp dụng định luật bảo toàn khối lượng
=> mAl2S3 = 5,4 + 9,6 = 15 gam

\(n_{Al_2S_3}=\dfrac{25.5}{150}=0.17\left(mol\right)\)
\(n_{Al}=\dfrac{10.8}{27}=0.4\left(mol\right)\)
\(2Al+3S\underrightarrow{^{t^0}}Al_2S_3\)
\(0.34...........0.17\)
\(H\%=\dfrac{0.34}{0.4}\cdot100\%=85\%\)

\(n_{Al_2S_3}=\dfrac{25,5}{150}=0,17\left(mol\right)\)
PTHH: 2Al + 3S --to--> Al2S3
0,34<----------0,17
=> \(H\%=\dfrac{0,34.27}{10,8}.100\%=85\%\)

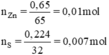
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S  ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

\(n_{Al} = \dfrac{5,4}{27} = 0,2(mol)\\ n_S = \dfrac{6,4}{32} = 0,2(mol)\)
2Al + 3S \(\xrightarrow{t^o}\) Al2S3
\(\dfrac{2}{15}\).......0,2..........\(\dfrac{1}{15}\)..........(mol)
Sau phản ứng :
\(m_{Al_2S_3} = \dfrac{1}{15}150 = 10(gam)\\ m_{Al\ dư} = (0,2 - \dfrac{2}{15}).27 = 1,8(gam)\)
dùng định luật bảo toàn khối lượng thì sẽ có khối lượng sản phẩm bằng tổng khối lượng các chất tham gia

nAl=10/27(mol)
ta ccó pthh: 2Al+3S->Al2S3( nhiệt dộ cao)
theo ptth=> nAl2S3(lý thuyết)=1/2.nAl=\(\dfrac{1}{2}.\dfrac{10}{27}\)=\(\dfrac{5}{27}\)(mol)
=> mAl2S3(lý thuyết)=\(\dfrac{5}{27}.150=\dfrac{250}{9}\)(g)
=>H=\(\dfrac{mAL2S3\left(thucte\right)}{mAL2S3\left(lythuyet\right)}.100\%=\dfrac{25,5}{\dfrac{250}{9}}=91,8\%\)

a) nAl=\(\frac{m_{Al}}{M_{Al}}\)=\(\frac{5,4}{27}\)=0,2 mol
nS=\(\frac{m_S}{M_S}\)=\(\frac{6,4}{32}\)=0,2 mol
\(\frac{n_{Al\left(đb\right)}}{n_{Al\left(pt\right)}}\)=\(\frac{0,2}{4}\)=0,05 (1)
\(\frac{n_{S\left(đb\right)}}{n_{S\left(pt\right)}}\)=\(\frac{0,2}{6}\)=0,03 (2)
0,05>0,03
Từ (1)(2) => Al có dư.Tính theo S
PTHH:\(4Al+6S=>2Al_2S_3\)
nAl(p/ư)=\(\frac{0,2.4}{6}\)=0,13 mol
\(n_{Al_2S_3\left(p.ứ\right)}\)=\(\frac{0,2.2}{6}\)=0,06 mol
nAl(dư)=nAl(đb)-nAl(p/ứ)=0,2-0,13=0,07 mol
mAl(dư)=0,07.27=1,89g
b) \(M_{Al_2S_3}\)=27.2+32.3=150 g/mol
\(m_{Al_2S_3}\)=0,06.150=9g

n Zn = 0,65/65 = 0,01 mol; n S = 0,224/32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
n ZnS = 0,007 mol
m ZnS = 0,007x97 = 0,679 (g)
n Zn dư = (0,01 - 0,007) = 0,003 mol
m Zn dư = 65.0,003 = 0,195g
ta có: nAl=5,4:27=0,2 mol
nS=6,4:32=0,2 mol
PTHH: 2Al + 3S \(\rightarrow\) Al2S3
ban đầu: 0,2 0,2 (mol)
phản ứng: 0,2 \(\leftarrow\) 0,2 (mol)
sau PƯ: 0 0 \(\frac{1}{15}\) (mol)
vậy sau phản ứng Al dư, S hết ( nhưng do cùng số mol nên Al hết)
mAL2S3= \(\frac{1}{15}.150=10\left(g\right)\)
bn gam câu a á