đốt cháy hoàn toàn 0,01 mol chất X bằng 1 lượng oxi vừa đủ là 0,616l thu được 1,344l hỗn hợp gồm CO2, N2, và nước. Sau khi ngưng tụ hơi nước hỗn hợp còn lại chiếm thể tích 0,56l và có tỉ khối với H2 là 20,4. Xác định công thức phân tử của X biết các khí đo ở dktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
giả sử 1 mol X gồm NH3 và C2H5NH2 → mX = 22,6 gam ⇄ 1 mol NH3 + 0,4 mol CH2.
→ quy X gồm 5x mol NH3 và 2x mol CH2 đốt cần 6,75x mol O2 → nkhông khí cần = 33,75x mol.
→ sản phẩm đốt CO2 + H2O + N2 (gồm cả N2 trong kk) là 2x mol CO2 + 9,5x mol H2O + 29,5x mol N2.
Biết tổng chúng là 43,4 gam → giải ra x = 0,04 mol → giải ra yêu cầu m = 4,52 gam.
p/s: NHANH HƠN: có m = 113x gam. từ O2 cần 6,75x mol → mkhông khí = 972x gam.
BTKL đốt cháy có: m + 972x = 43,4. Theo đó giải hệ ra x = 0,04 mol và m = 4,52 gam.

Có \(\left\{{}\begin{matrix}n_{H_2}+n_{C_2H_2}=\dfrac{17,92}{22,4}=0,8\\\dfrac{2.n_{H_2}+26.n_{C_2H_2}}{n_{H_2}+n_{C_2H_2}}=0,5.28=14\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{H_2}=0,4\left(mol\right)\\n_{C_2H_2}=0,4\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{51,2}{32}=1,6\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,4-->0,2
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,4----->1------------>0,8
=> Y chứa \(\left\{{}\begin{matrix}CO_2:0,8\left(mol\right)\\O_{2\left(dư\right)}:0,4\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_Y=\dfrac{0,8.44+0,4.32}{0,8+0,4}=40\left(g/mol\right)\)
\(\overline{M}_X=14\left(g/mol\right)\)
=> \(d_{X/Y}=\dfrac{14}{40}=0,35\)

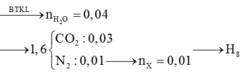


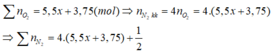

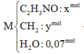
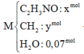
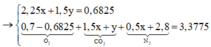
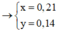
mình ra C2H7O2N đúng ko