Cho 1 hỗn hợp gồm Na,Al,Fe -Nếu cho hỗn hợp tác dụng với nước dư được V lít khí -Nếu cho hh t/d với NaOh dư thu được 7/4 V lít khí -Nếu cho hh t/d với HCl dư thu được 9/4 V lít khí.
a) viết phương trình các phản ứng xảy ra
b)xác định tỷ lệ mol các kim loại có trong hỗn hợp .Biết rằng khí thu được ở các trường hợp trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt x,y, z lần lượt là số mol của Na,Al,Mg trong m gam hỗn hợp A
m gam A + H2O dư
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
x--------------------x--------->0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x<------x-------------------------------------->1,5x
=> \(0,5x+1,5x=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) (1)
2m gam A + NaOH
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
2x------------------------------->x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2y---------------------------------------------->3y
=> \(x+3y=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) (2)
3m gam A + HCl
\(Na+HCl\rightarrow NaCl+\dfrac{1}{2}H_2\)
3x--------------------------->1,5x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
3y----------------------------->4,5y
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
3z----------------------------->3z
=> \(1,5x+4,5y+3z=\dfrac{22,4}{22,4}=1\left(mol\right)\) (3)
Từ (1), (2), (3) =>\(\left\{{}\begin{matrix}x=0,05\\y=\dfrac{7}{60}\\z=\dfrac{2}{15}\end{matrix}\right.\)
=> \(m_{Na}=0,05.23=1,15\left(g\right)\)
\(m_{Al}=\dfrac{7}{60}.27=3,15\left(g\right)\)
\(m_{Mg}=\dfrac{2}{15}.24=3,2\left(g\right)\)
=> \(m=1,15+3,15+3,2=7,5\left(g\right)\)
=> \(\%m_{Na}=\dfrac{1,15}{7,5}.100=15,33\%\)
\(\%m_{Al}=\dfrac{3,15}{7,5}.100=42\%\)
\(\%m_{Mg}=\dfrac{3,2}{7,5}.100=42,67\%\)

\(2Na+2H2O\rightarrow2NaOH+H2\left(1\right)\)
\(2Al+2NaOH+2H2O\rightarrow2NaAlO2+3H2\left(2\right)\)
\(2Al+6HCl\rightarrow2AlCl3+3H2\left(3\right)\)
\(2Na+2HCl\rightarrow2NaCl+H2\left(4\right)\)
\(Mg+2HCl\rightarrow MgCl2+H2\left(5\right)\)
\(n_{H2\left(1\right)}=0,1\left(mol\right)\rightarrow n_{Na}=0,2\left(mol\right)\rightarrow m_{Na}=4,6\left(g\right)\)
\(n_{H2\left(2\right)}=0,4\left(mol\right)\Rightarrow n_{Al}=\dfrac{4}{15}\left(mol\right)\Rightarrow m_{Al}=7,2\left(g\right)\)
\(\Rightarrow n_{H2\left(3\right)}=\dfrac{3}{2}n_{Al}=0,4\left(mol\right)\)
\(n_{H2\left(4\right)}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow n_{H2\left(5\right)}=1-0,4-0,1=0,5\left(mol\right)\)
\(\Rightarrow n_{Mg}=0,5\left(mol\right)\Rightarrow m_{Mg}=12\left(g\right)\)
\(\Rightarrow m=12+4,6+7,2=23,8\left(g\right)\)
\(\%m_{Na}=\dfrac{4,6}{23,8}.100\%=19,33\%\)
\(\%m_{Al}=\dfrac{7,2}{23,8}.100\%=30,25\%\)
\(\%m_{Mg}=100-19,33-30,25=50,42\%\)
Chúc bạn học tốt

Cho V lít = 1 lít ; số lít coi như là số mol cho dễ tính
Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al
Còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%

Đáp án B
n Fe = 0 , 01 ; n Fe 2 O 3 = 0 , 1
Phản ứng: 2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Vì D phản ứng với dung dịch NaOH dư có xuất hiện khí H2 nên Al dư sau phản ứng.
Gọi n Al du = a , n Fe = n Al phan ung = 2 n Fe 2 O 3 = 0 , 2
Các phản ứng tạo khí:
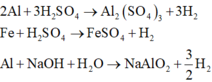
Khi cho D tác dụng với dung dịch H2SO4 thì n H 2 = 3 2 n Al + n Fe
Khi cho D tác dụng với dung dịch NaOH thì n H 2 = 3 2 n Al
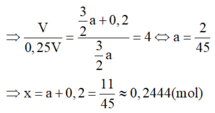

Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Na}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a--------------------------->a
\(2Na+2HCl\rightarrow2NaCl+H_2\)
b---------------------------->0,5b
Ta có: \(m_M=\dfrac{1}{2}.\left(m_{Fe}+m_{Na}\right)=\dfrac{1}{2}.\left(56a+23b\right)=28a+11,5b\left(g\right)\)
PTHH: \(M+2HCl\rightarrow MCl_2+H_2\)
(a+0,5b)<----------------(a+0,5b)
\(\Rightarrow M_M=\dfrac{28a+11,5b}{a+0,5b}\\ \Rightarrow\dfrac{28a}{a}>M_M>\dfrac{11,5a}{0,5a}\\ \Leftrightarrow28>M_M>23\)
Vậy M là Magie (Mg)

Đáp án : D
Na + H2O -> NaOH + 1 2 H2
NaOH + Al + H2O -> NaAlO2 + 3 2 H2
Vì nNa > nAl => chất rắn chỉ còn Fe
⇒ n F e = n H 2 s a u = 0 , 25 V 22 , 4 ( m o l )
⇒ n H 2 = 1 2 n N a + 3 2 n A l = V 22 , 4
Mà nAl : nNa = 4 : 5
=> nAl = 8V/(17.22,4) ; nNa = 10V/(17.22,4)
=> %mFe = 34,80%
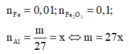
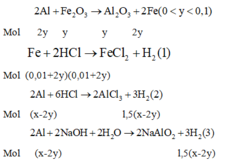

Xét phản ứng (2) và (3) ta có: $n_{Fe}=\frac{9a}{4}-\frac{7a}{4}=\frac{a}{2}(mol)$
Gọi số mol Na và Al lần lượt là x;y
Xét phản ứng (1):
$2Na+2H_2O\rightarrow 2NaOH+H_2$
$2Al+2NaOH+2H_2O\rightarrow 2NaAlO_2+3H_2$
$\Rightarrow n_{H_2}=a=2x\Rightarrow n_{Na}=\frac{a}{2}(mol)$
Xét phản ứng (2) bảo toàn e ta có:
$n_{Al}=y=\frac{5a}{6}(mol)$
$\Rightarrow n_{Na}:n_{Al}:n_{Fe}=3:5:3$
Lớp 9 đã học bảo toàn e đâu !