Đốt cháy 36g FeS2 với 13,44 lít khí O2 (đktc). Sau phản ứng thu được 28g hỗn hợp rắn X và V lít hỗn hợp khí Y. Tính hiệu suất phản ứng và thành phần % thể tích các khí trong Y ( các khí được đo cùng điều kiện)
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

13 tháng 3 2023
a, \(CH_4+2O_2\underrightarrow{^{t^o}}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{^{t^o}}2CO_2+2H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{15,68}{22,4}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=-0,1\\y=0,3\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.


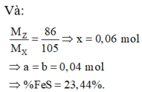
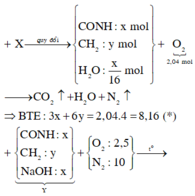
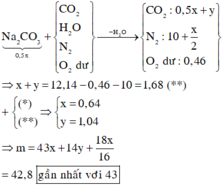
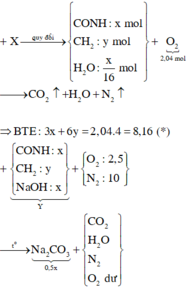

$n_{FeS_2} = \dfrac{36}{120} = 0,3(mol)$
$n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
Vì \(\dfrac{n_{FeS_2}}{4} = 0,075 > \dfrac{n_{O_2}}{11} = 0,0545\) nên $FeS_2$ dư
Gọi hiệu suất là a
\(n_{O_2\ pư} = 0,6a(mol)\\ n_{FeS_2} = \dfrac{4}{11}n_{O_2\ pư} = \dfrac{12a}{55}(mol)\\ n_{Fe_2O_3} = \dfrac{2}{11}n_{O_2\ pư} = \dfrac{6a}{55}(mol)\)
Suy ra :
120.(0,3 - 12a/55 )+ 160.6a/55 = 28
Suy ra a = 0,9167 = 91,67%
Sau phản ứng , khí gồm :
O2 dư : 0,6 - 0,6a = 0,05(mol)
SO2 : 0,4(mol)
Suy ra :
%V O2 = 0,05/(0,05 + 0,4) .100% = 11,11%
%V SO2 = 100% - 11,11% = 88,89%
thanks