Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P và H N O 3 đặc
3 P + 5 H N O 3 + 2 H 2 O → 3 H 3 P O 4 + 5 N O
Đáp án A

Đáp án D
PTHH : Ca3(PO4)2 → 2H3PO4
nCa3(PO4)2 =5299.0,78:310=13,33 mol → nH3PO4 = 13,33.0,75.2.0,005=0,1 mol
Các phương trình có thể xảy ra là : H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + 2NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → NaH2PO4 + H2O
Nếu chất rắn chỉ có muối
Lượng muối tạo ra tối đa khi tạo thành Na3PO4 => mNa3PO4 = 0,1.164 =16,4 < 17,2 → còn dư NaOH
→ chỉ tạo muối Na3PO4: 0,1 mol và còn dư NaOH : 0,8g hay 0,02 mol
Bảo toàn nguyên tố Na có 0,1.3 + 0,02 = nNaOH = 0,32 =0,1x → x =3,2M
Đáp án D
Chú ý:
Chỉ 0,05% lượng axit được tạo ra mới tham gia phản ứng với NaOH

\(m_{Ca_3\left(PO_4\right)_2}=5.35\%=1,75\left(tấn\right)\)
Trong 1 mol Ca3(PO4)2 có 1 mol P2O5
=> Trong 310 tấn Ca3(PO4)2 tương ứng có 142 tấn P2O5
=> Trong 1,75 tấn Ca3(PO4)2 tương ứng có x tấn P2O5
=> x=\(\dfrac{1,75.142}{310}=0,8\left(tấn\right)\)
=> Chọn B
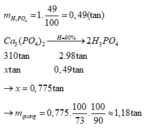
Trong công nghiệp, ngưởi ta điều chế axit photphoric theo 2 cách, tuy nhiên trong phòng công nghiệp, người ta điều chế bằng phản ứng:
3P + 5HNO3 → 3H3PO4 + 5NO↑
Đáp án D