Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)benzen có phản ứng cộng và phản ứng thế (tức là tính thơm đó)
+) C6H6 + Cl2 -->(as) C6H5Cl +HCl ( pứ thế )
+)C6H6 + H2 --> 3C6H12 ( pứ cộng)
b)Toluen cũng có phản ứng Clo hóa giống ankan
C6H5CH3 + Cl2 --> (as thì mới có phản ứng thế vào nhánh) C6H5CH2Cl + HCl
nhưng với xúc tác (Fe ) thì tham gia phản ứng vào vòng theo cơ chế AE
c)Stiren cũng có phản ứng cộng giống anken.
C6H5CH=CH2 + Br2 --> C6H5CHBr-CH2Br

Những phương trình phản ứng hóa học chứng minh:
a) Axit clohiđric tham gia phản ứng oxi hóa – khử với vai trò là chất khử:
b) Axit clohiđric tham gia phản ứng không oxi hóa – khử:
CaCO3 + 2HCl \(\rightarrow\) CaCl2 + CO2 + H2O.
CuO + 2HCl \(\rightarrow\) CuCl2 + H2O.

Ba thí dụ phản ứng phân hủy là phản ứng oxi hoá – khử :
CaCO3 -tº\(\rightarrow\) CaO + CO2\(\uparrow\)
NH4Cl -tº\(\rightarrow\) NH3 + HCl
Cu(OH)2 -tº\(\rightarrow\) CuO + H2O
Ba thí dụ phản ứng phân hủy không là phản ứng oxi hoá – khử
Cu(OH)2 -tº\(\rightarrow\)CuO + H2O
СаСОз -tº\(\rightarrow\) CaO + CO2
H2CO3 -tº\(\rightarrow\) CO2 + H2O.

A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai vế của phương trình phản ứng phải bằng nhau.

Trong phản ứng hóa học , phản ứng nào có sự chuyển dịch electron điều liên quan đến "điện hóa". Khi này phản ứng nào có chênh lệch thế điện hóa (ΔE)càng lớn càng dễ dàng phán ứng, tức ưu tiên xảy ra trước.
Vậy thì trong hệ có bao nhiêu cặp có thể sinh ra chênh lệch thế điện hóa cứ liệt kê ra. Ở mỗi cặp phải có một tác nhân cho electron và một tác nhân nhận electron thì mới tạo thành một phản ứng điện hóa. Trường hợp này có 3 cặp :
Cặp 1 : Fe3+ + 1 e --> Fe2+ Eo = 0.771
...........Zn - 2e --> Zn2+ Eo = -0.763
=> ΔE = 0.771 - (-0.763) = 1.534
Cặp 2 : Fe2+ + 2 e --> Fe Eo = -0.44
............Zn - 2e ---> Zn2+ Eo = -0.763
=> ΔE = -0.44 - (-0.763) = 0.296
Cặp 3 : 2H+ + 2 e ---> H2 Eo = 0
............ Zn - 2 e --> Zn2+ Eo = -0.763
=> ΔE = 0 - (-0.763) = 0.763
Xếp từ lớn tới bé : Cặp 1 > Cặp 3 > Cặp 2
Vậy cặp 1 xảy ra trước nhất, khi không còn tác nhân đảm bảo cho cặp 1 , đến cặp 3, tương tự cho đến cặp 2 . Nghĩa là Zn phản ứng với Fe3+ để tạo thành Fe2+, sau đó hết Fe3+ mà vẫn còn kẻm thì Zn tác dụng với H+ tạo thành H2 , khi hết H+ mà vẫn còn Zn, Zn tác dụng với Fe2+ tạo thành Fe. Bạn đã nghĩ đúng.
~~~~~~~~~~~~~~~~~~~
Bài giải trên chỉ đúng trong trường hợp tất cả các tác nhân điều có nồng độ 1 mol/l
Nếu nồng độ các tác nhân khác nhau , lúc này phải tích chênh lệch thế điện hóa cân bằng, ký hiệu Ecb. Với Ecb được tính bằng công thức :
Ecb = Eo + 0.059/n . log ([Ox]/[Kh])
trong đó n là cái số trong phương trình này: Kh - n e --> Ox
[Ox] - nồng độ tác nhân Oxi hóa
[Kh] - nồng độ tác nhân khử
Theo công thức trên khi [Ox] = [Kh] = 1 mol/l thì log([Ox]/[Kh]) = log(1) = 0 vậy Ecb = Eo

Sở dĩ phản ứng thế luôn luôn là loại phản ứng oxi hoá – khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
phản ứng thế luôn luôn là loại phản ứng oxi hoá - khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi sô' oxi hoá của các nguyên tố.

Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g
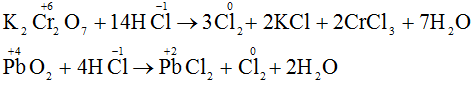
.jpg)
Đáp án đúng : D