Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

\(n_{H_2} = \dfrac{448}{1000.22,4} = 0,02(mol)\\ \Rightarrow n_{HCl} = 2n_{H_2} = 0,02.2 = 0,04(mol)\\ m_{muối} = m_X + m_{HCl} - m_{H_2} = 1,53 + 0,04.36,5 - 0,02.2 = 2,95\ gam\)

có nH2 = 1,12/22,4 = 0,05 mol
Áp dụng ĐLBT nguyên tố với H :
có nHCl = 2nH2 = 0,05.2 =0,1 mol
Áp dụng ĐLBT khối lượng , có :
mKL + mHCl = m muối + mH2
➜ m muối = 2 + 0,1.36,5 - 0,05.2 = 5,55 gam
có mCl-thêm vào= mmuối(TN2)-mmuối(TN2)=5,763-5,55 = 0,213 gam
⇒ nCl-thêm vào = 0,213/35,5 = 0,006 mol
PTHH :
FeCl2 + Cl- → FeCl3
0,006 0,006 (mol)
⇒ nFeCl2= nCl =0,006 mol
BTNT với Fe , có nFe = nFeCl2 = 0,006 mol
⇒ %mFe = \(\frac{0,006.56}{2}\) .100% = 16,8%

Các chất tác dụng với HNO3 đặc nóng dư tạo phản ứng oxi hóa khử gồm: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3. Đáp án A.

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)

Đáp án D.
Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử xảy ra giữa H2SO4 dư, dặc, nóng với lần lượt các chất: Fe, FeO, Fe(OH)2, Fe3O4,Fe(NO3)2, FeSO4, FeCO3. (Hợp chất mà trong đó Fe chưa đạt số oxi hóa là +3).

Cân bằng phương trình phản ứng sau:
a) 2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O
b) 4Mg + 5H2SO4 -> 4MgSO4 + H2S +4 H2O
c) 3Zn + 4H2SO4 -> 3ZnSO4 + S + 4H2O
d) 3Mg + 8HNO3 -> 3Mg(NO3)2 + 2NO + 4H2O
e) 8Al +30HNO3 -> 8Al(NO3)3 + 3N2O + 15H2O
f) 2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
k) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
cân bằng thì đúng nhưng không phù hợp
Bởi đây là hóa lớp 10 chắc là cân bằng oxh hóa khử hay cân bằng pt e
Nên e làm sai nhé cần phải có cách trình bày ms ra đc như v
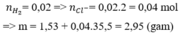
Trong phản ứng hóa học , phản ứng nào có sự chuyển dịch electron điều liên quan đến "điện hóa". Khi này phản ứng nào có chênh lệch thế điện hóa (ΔE)càng lớn càng dễ dàng phán ứng, tức ưu tiên xảy ra trước.
Vậy thì trong hệ có bao nhiêu cặp có thể sinh ra chênh lệch thế điện hóa cứ liệt kê ra. Ở mỗi cặp phải có một tác nhân cho electron và một tác nhân nhận electron thì mới tạo thành một phản ứng điện hóa. Trường hợp này có 3 cặp :
Cặp 1 : Fe3+ + 1 e --> Fe2+ Eo = 0.771
...........Zn - 2e --> Zn2+ Eo = -0.763
=> ΔE = 0.771 - (-0.763) = 1.534
Cặp 2 : Fe2+ + 2 e --> Fe Eo = -0.44
............Zn - 2e ---> Zn2+ Eo = -0.763
=> ΔE = -0.44 - (-0.763) = 0.296
Cặp 3 : 2H+ + 2 e ---> H2 Eo = 0
............ Zn - 2 e --> Zn2+ Eo = -0.763
=> ΔE = 0 - (-0.763) = 0.763
Xếp từ lớn tới bé : Cặp 1 > Cặp 3 > Cặp 2
Vậy cặp 1 xảy ra trước nhất, khi không còn tác nhân đảm bảo cho cặp 1 , đến cặp 3, tương tự cho đến cặp 2 . Nghĩa là Zn phản ứng với Fe3+ để tạo thành Fe2+, sau đó hết Fe3+ mà vẫn còn kẻm thì Zn tác dụng với H+ tạo thành H2 , khi hết H+ mà vẫn còn Zn, Zn tác dụng với Fe2+ tạo thành Fe. Bạn đã nghĩ đúng.
~~~~~~~~~~~~~~~~~~~
Bài giải trên chỉ đúng trong trường hợp tất cả các tác nhân điều có nồng độ 1 mol/l
Nếu nồng độ các tác nhân khác nhau , lúc này phải tích chênh lệch thế điện hóa cân bằng, ký hiệu Ecb. Với Ecb được tính bằng công thức :
Ecb = Eo + 0.059/n . log ([Ox]/[Kh])
trong đó n là cái số trong phương trình này: Kh - n e --> Ox
[Ox] - nồng độ tác nhân Oxi hóa
[Kh] - nồng độ tác nhân khử
Theo công thức trên khi [Ox] = [Kh] = 1 mol/l thì log([Ox]/[Kh]) = log(1) = 0 vậy Ecb = Eo