Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong công nghiệp để điều chế H3PO4 có độ tinh khiết và nồng độ cao người ta đốt cháy P để được P2O5 , rồi cho P2O5 tác dụng với nước
Đáp án C

Đáp án B
Hướng dẫn giải:
Ta áp dụng bảo toàn nguyên tố hiđro:
nCa(H2PO4)2= 1,5 kmol → nH= 1,5.4= 6 kmol → nH2SO4= 3 kmol
→mH2SO4= 3.98= 294 (kg)→ mdd H2SO4 70%= 294. 100/70= 420 (kg)
Biết hiệu suất của quá trình là 70% → mdd H2SO4 70% thực tế=420.100/70= 600 (kg)
K3PO4 -> Ca3(PO4)2
Ca3(PO4)2 ---> Ca(H2PO4)2
Mọi người viết phương trình giúp em với ạ , em cảm ơn ạ

2K3PO4+Ca(OH)2-----------> Ca3(PO4)2+2KOH
Ca3(PO4)2+4H3PO4-------->3Ca(H2PO4)2

Đáp án B
Hướng dẫn giải:
Trong 100 kg bột quặng ta có: mCa3(PO4)2= 100. 73%= 73 kg; mCaCO3= 100.26%= 26kg
→ nCa3(PO4)2= 73/ 310 (kmol)=0,235 kmol; nCaCO3= 26/100= 0,26kmol
Ca3(PO4)2+ 2H2SO4 → Ca(H2PO4)2+ 2CaSO4
0,235 → 0,47 kmol
CaCO3+ H2SO4 → CaSO4+ CO2+ H2O
0,26 → 0,26 kmol
→ Tổng số mol H2SO4 là 0,47 + 0,26= 0,73 kmol → mH2SO4= 0,73.98= 71,54 (kg)
→ mdd H2SO4= 71 , 54 × 100 65 = 110 , 06 ( k g )

Chọn đáp án C
cần chú ý là trong công nghiệp và yêu cầu độ tinh khiết cao.
Cách A hoặc B, D đều thu được H3PO4 nhưng không tinh khiết và có chất lượng thấp.
Thực tế trong CN, có hai hướng:
• phương pháp ướt: Ca5(PO4)3X + 5H2SO4 + 10H2O → 3H3PO4 + 5CaSO4 + 2H2O + HX
(Ca5(PO4)3X là các quặng khoáng vật có trong thiên nhiên như apatit, photphorit).
• phương pháp nhiệt: P + O2 ―t0→ P2O5 sau P2O5 + H2O → H3PO4.
phương pháp ướt thì kinh tế, thương mại hơn, phương pháp nhiệt thì đắt hơn nhưng cần thiết, dùng sản xuất một sản phẩm tinh khiết được sử dụng cho các ứng dụng trong ngành công nghiệp thực phẩm.
Tóm lại chọn đáp án C
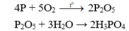
Trong công nghiệp, để điều chế H 3 P O 4 không cần độ tinh khiết cao, người ta H 2 S O 4 đặc tác dụng với quặng photphorit hoặc quặng apatit
C a 3 ( P O 4 ) 2 + 3 H 2 S O 4 → 3 C a S O 4 + 2 H 3 P 4
Đáp án A