Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
(a) SiO2 + 4HF ® SiF4 + 2H2O
(b) SO2 + 2H2S ® 3S + 2H2O
(c) 2NH3 + 3CuO → t ° N2 + 3Cu + 3H2O
(d) CaOCl2 + 2HCl đặc ® CaCl2 + 2Cl2 + H2O
(e) Si + 2NaOH + H2O ® Na2SiO3 + 2H2
(g) NH4Cl + NaNO2 → t ° N2 + NaCl + 2H2O

Chọn A
(a)Không, SiO 2 + 4 HF → SiF 4 ↑ + 2 H 2 O
(b)Có, SO 2 + H 2 S → 3 S ↓ + 2 H 2 O
(c)Có, 2 NH 3 + 3 CuO → t ° 3 Cu + N 2 + 3 H 2 O
(d)Có, CaOCl 2 + 2 HCl → CaCl 2 + Cl 2 + H 2 O
(e)Có, Si + 2 NaOH + H 2 O → Na 2 SiO 3 + 2 H 2 ↑
(f)Có, 2 Ag + O 3 → Ag 2 O + O 2
(g)Có, NH 4 Cl + NaNO 3 → t ° N 2 + 2 H 2 O + NaCl

Chọn đáp án C
(a) Cho SiO2 tác dụng với axit HF: SiO2 + 4HF → SiF4 + 2H2O
(b) Cho SO2 tác dụng với H2S: SO2 + 2H2S → 3S + 2H2O
(c) Cho NH3 tác dụng với CuO: 2NH3 + 3CuO → 3Cu + N2 + 3H2O
(d) Cho CaOCl2 tác dụng với HCl đặc: CaOCl2 + 2HClđ → CaCl2 + Cl2 + H2O
(e) Cho Si tác dụng với NaOH: Si + 2NaOH + H2O → Na2SiO3 + 2H2.
(f) Cho O3 tác dụng với Ag: O3 + 2Ag → Ag2O + O2.
(g) Cho NH4Cl tác dụng với NaNO2 đun nóng: NH4Cl + NaNO2 → NaCl + N2 + 2H2O.
Vậy số đơn chất được tạo thành là: 6

Đáp án D

Kiến thức cần nhớ
Silic (Si)
* Silic có 2 dạng thù hình là silic vô định hình và silic tinh thể.
Silic vô định hình: là chất bột màu nâu, không tan trong nước nhưng tan trong kim loại nóng chảy.
Silic tinh thể: có màu xám, có ánh kim, có cấu trúc giống kim cương nên có tính bán dẫn.
* Các mức oxi hóa có thể có của Si: -4; 0; +2; +4 (số oxi hóa +2 ít đặc trưng) nên Si có cả tính khử và tính oxi hóa.
Si + 2Fe2 → SiF4
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SILIC ĐIOXIT (SiO2)
* Là chất ở dạng tinh thể nguyên tử, không tan trong nước. Trong tự nhiên chủ yếu tồn tại ở dạng khoáng vật thạch anh.
* SiO2 có tính chất của oxi axit, tan chậm trong dung dịch kiềm và tan dễ trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy → silicat.
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
* SiO2 tan trong HF; phản ứng này dùng để khắc chữ lên bề mặt thủy tinh
Axit H2SiO3
* Dạng keo, không tan trong nước, khi đun nóng dễ bị mất nước
* Khi sấy khô H2SiO3 mất một phần nước tạo thành vật liệu xốp là silicagen được dùng làm chất hút ẩm và hấp phụ nhiều chất.
* Là axit yếu, yếu hơn axit cacbonic nên điều chế bằng cách dùng axit mạnh đẩy ra khỏi muối hoặc thủy phân một số hợp chất của Si. Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
Muối silicat
* Là muối của axit silicic thường không màu, khó tan (trừ muối kim loại kiềm tan được).
* Dung dịch đậm đặc của Na2SiO3 được gọi là thủy tinh lỏng được dùng để chế tạo keo dán thủy tinh và sứ, bảo quản vải và gỗ khỏi bị cháy. Trong dung dịch, silicat của kim loại kiềm bị thủy phân mạnh tạo môi trường bazơ.
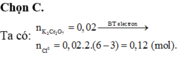
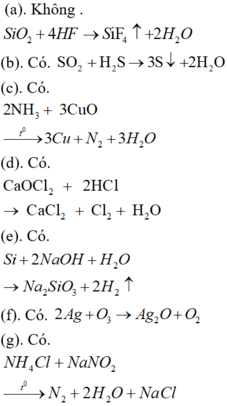
Chọn A.
(a) SiO2 + 4HF ® SiF4 + 2H2O
(b) SO2 + 2H2S ® 3S + 2H2O
(c) 2NH3 + 3CuO ® N2 + 3Cu + 3H2O
(d) CaOCl2 + 2HCl đặc ® CaCl2 + 2Cl2 + H2O
(e) Si + 2NaOH + H2O ® Na2SiO3 + 2H2
(g) NH4Cl + NaNO2 ® N2 + NaCl + 2H2O