Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Do X dễ nhường 2 electron để đạt cấu hình bền vững => X có số oxi hóa +2
Y dễ nhận 3 electron để đạt cấu hình bền vững => Y có số oxi hóa -3
=> Công thức phù hợp là X3Y2

X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
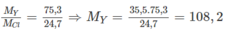
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))

Các nguyên tố kim loại thuộc nhóm IA có số electron ở lớp ngoài cùng là 1, có thể nhường 1 electron này nên có điện hóa trị 1+.
Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6,7 electron ở lớp ngoài cùng, có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng nên có điện hóa trị 2- hay 1-.

Đáp án D
Hướng dẫn X thuộc nhóm IA,IIA nên có điện hóa trị +1,+2
Y thuộc cùng nhóm VIA,VIIA nên Y có điện hóa trị -2 và -1
Ngoài ra ZX + ZY = 20. Vì X, Y thuộc hai chu kì kế cận nên nghiệm thích hợp là
ZX = 11 thì ZY = 9 ; X là Na , Y là F và XY là NaF
ZX = 12 thì ZY = 8 ; X là Mg , Y là O và XY là MgO

a)
Do R thuộc nhóm VA
=> CTHH của R và H là: RH3
Có \(\dfrac{3}{M_R+3}.100\%=17,64\%=>M_R=14\left(g/mol\right)\)
=> R là N
b) Do CTHH của R và H là RH3
=> oxit cao nhất của R là R2O5
Có: \(\dfrac{16.5}{2.M_R+16.5}.100\%=74,07\%=>M_R=14\left(g/mol\right)\)
=> R là N
Đáp án B
Do X dễ nhường 1 electron để đạt cấu hình bền vững → X có số oxi hóa +1
Y dễ nhận 2 electron để đạt cấu hình bền vững → Y có số oxi hóa -2
→ Công thức phù hợp là X2Y