Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1
- Trích 4 mẫu thử:
-Cho quỳ tím vào 4 mẫu:
+ Quỳ tím hóa đỏ\(\rightarrow\)HCl, H2SO4
+ Quỳ tím không đổi màu\(\rightarrow\)Ba(NO3)2 và NaCl
- Lẫy một ít mẫu thử từ 2 mẫu không làm đổi màu quỳ tím lần lượt vào 2 mẫu làm quỳ tím hóa đỏ:
+ Nếu có kết tủa trắng chứng tỏ mẫu lấy là Ba(NO3)2 và mẫu làm quỳ tím hóa đỏ là H2SO4:
Ba(NO3)2 +H2SO4\(\rightarrow\)BaSO4\(\downarrow\)+2HNO3
+ Mẫu lấy còn lại là NaCl và mẫu làm quỳ tím hóa đỏ là HCl
Bài 1d:
Hòa tan 2 mẫu thử vào nước, sau đó thử bằng quỳ tím:
+ Nếu quỳ tím hóa xanh là mẫu CaO:
CaO+H2O\(\rightarrow\)Ca(OH)2
+ nếu quỳ tím hóa đỏ là mẫu P2O5:
P2O5+3H2O\(\rightarrow\)2H3PO4

Điều chế dung dịch BaCl2: Cho dung dịch Ba(OH)2 vào ống nghiệm, cho tiếp quỳ tím vào, quỳ tím hoá xanh. Cho từ từ dung dịch HCl vào đến khi quỳ chuyển sang màu tím thì dừng lại, ta điều chế được dd BaCl2
Ptpư: Ba(OH)2 + 2HCl → BaCl2 + 2H2O
- Lấy một lượng nhỏ từng dung dịch X, Y, Z cho vào từng ống nghiệm riêng biệt đánh số thứ tự
+ Cho dd BaCl2 vào từng ống nghiệm đến dư, các ống nghiệm đều tạo kết tủa trắng: Kết tủa từ X chứa BaCO3; từ Y chứa BaSO4; từ Z chứa hỗn hợp BaCO3 và BaSO4.
Ptpư: K2CO3 + BaCl2 → BaCO3 + 2KCl
K2SO4 + BaCl2 → BaSO4 + 2KCl
+ Cho dung dịch HCl tới dư vào từng ống nghiệm chứa các kết tủa: Nếu kết tủa nào tan hết thì ban đầu là dd X, nếu kết tủa tan một phần thì đó là dd Z, còn lại là dd Y
BaCO3 + 2HCl → BaCl2 + CO2 + H2O
tham khảo đi


C2H4, C3H6, C4H8 cùng là anken nên có công thức chung là CnH2n
2CO + O2 → 2CO2↑ (1)
x → x (mol)
2H2 + O2 → 2H2O (2)
y → y (mol)
CnH2n + O2 → nCO2 + 2nH2O (3)
Sản phẩm cháy thu được gồm có CO2 và H2O.
Khi hấp thụ vào dd Ca(OH)2: 0,04 mol thu được dung dịch Y, thêm từ từ Ba(OH)2 vào dung dịch Y thu được kết tủa của các ion kim loại => CO2 phản ứng với Ca(OH)2 theo phương trình:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (4)
CO2 + Ca(OH)2 → Ca(HCO3)2 + H2O (5)
Dd Y chứa Ca(HCO3)2
BaCl2 + Ca(HCO3)2 → CaCO3↓ + BaCO3↓ + H2O (6)
m1 = mCaCO3(4)
m2 = mCaCO3(5) + mBaCO3
=> m1 + m2 = ∑ mCaCO3↓ + mBaCO3 = 6,955 (g) (*)
BTNT Ca: => ∑nCaCO3↓ = ∑ nCa(OH)2 (4+5) = 0,04 (mol)
Từ (*)

=> nCaCO3(6) = nBaCO3 = 0,015 (mol)
=> nCaCO3(4) = ∑nCa(OH)2 – nBaCO3 = 0,04 – 0,015 = 0,025 (mol)
BTNT C => ∑ nCO2 = ∑ nCaCO3 + nBaCO3 = 0,04 + 0,015 = 0,055 (mol)
Khối lượng dd Y tăng 0,82 gam so với dd Ca(OH)2 ban đầu
=> mCO2 + mH2O – mCaCO3(4) = 0,82
=> mH2O = 0,82 + 0,025.100 – 0,055.44 = 0,9 (g)
=> nH2O = 0,9 : 18 = 0,05 (mol)
BTKL ta có: mhhX + mO2 = mCO2 + mH2O
=> mO2 = 0,055.44 + 0,9 – 0,92 = 2,4 (g) => nO2 = 0,075 (mol)
BTNT O: nO( trong CO) + 2nO2 = 2nCO2 + nH2O
=> nO( trong CO) = 2.0,055 + 0,05 – 0,075.2 = 0,01 (mol) => nCO = 0,01 (mol)
Từ PTHH (1), (2), (3) ta thấy khi đốt cháy CnH2n luôn cho nH2O = nCO2 => sự chênh lệch mol CO2 và mol H2O là do đốt cháy CO và H2
=> nCO2 – nH2O = x – y = 0,055 – 0,05 = 0,005 (mol)
Mặt khác: nCO – nH2 = x – y = 0,005 (mol)
=> nH2 = nCO – 0,005= 0,01 – 0,005 = 0,055 (mol)
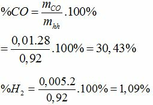

1C ; 2A; 3B ; 4D ; 5B ; 6C
B1:
(1) 4Na + O2 ---> 2Na2O
(2) Na2O + H2O ----> 2NaOH
(3) 2NaOH + CO2 ---> Na2CO3 + H2O
(4)Na2CO3 +MgSO4--->Na2SO4+ MgCO3
(5) Na2SO4 + BaCl2 ---> BaSO4 +2NaCl
(6) NaCl + AgNO3 ---> NaNO3 + AgCl
B2: _ trich một ít
_ nhỏ vào giấy quỳ tím thấy chuyen thành xanh la Ba(OH)2
_ cho dd BaCl2 vào, ta thấy có kết tủa là Na2SO4
Na2SO4 + BaCl2 ---> NaCl + BaSO4
_ còn lại NaCl

Bài 1:
a) K: 2K + 2HCl---> 2KCl+ H2
2K + 2H2O ---> 2KOH + H2 (nếu K dư)
Zn: Zn+ 2HCl--> ZnCl2 + H2
Cu: ko có pứ
AgNO3: AgNO3+ HCl ---> AgCl + HNO3
CuO : CuO + 2HCl --> CuCl2 + H2O
NaOH: NaOH + HCl --> NaCl + H2O
Na2SO4: ko có pứ
Mg(OH)2: Mg(OH)2 + 2HCl--> MgCl2 + 2H2O
K2CO3: K2CO3 + 2HCl --- > 2KCl + CO2 + H2O
Al2O3: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
b) Na: 2Na + 2H2O --> 2NaOH
CO2: CO2 + Ba(OH)2 ---> BaCO3 + H2O (nếu Ba(OH)2 dư)
2CO2 + Ba(OH)2 ---> Ba(HCO3)2 (nếu CO2 dư)
H2SO4: Ba(OH)2 + H2SO4 --> BaSO4 + 2H2O
HCl: Ba(OH)2 + 2HCl ---> BaCl2 + H2O
MgSO4: MgSO4 + Ba(OH)2 --> Mg(OH)2 + BaSO4
Al2O3: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
NaCl: ko pứ
CuCl2: CuCl2 + Ba(OH)2 ---> Cu(OH)2 + BaCl2
c) K: 2K + 2H2O --> 2KOH + H2
Mg: ko pứ
H2SO4: Na2CO3 + H2SO4 --> Na2SO4 + CO2 + H2O
KOH: ko pứ
Ca(OH)2: Ca(OH)2 + Na2CO3 --> 2NaOH + CaCO3
BaCl2: BaCl2 + Na2CO3 --> 2NaCl + BaCO3
KCl: ko pứ
Bài 2: A: Fe2O3 B: FeCl3
D: Fe(OH)3 E: Fe2O3
4Fe + 3O2 ---> 2Fe2O3
Fe2O3 + 6HCl---> 2FeCl3+ 3H2O
FeCl3 + 3NaOH --> Fe(OH)3 + 3NaCl
2Fe(OH)3 ----> Fe2O3 + 3H2O

\(M_{NO}=M_{C2H6}=30\rightarrow M_{Y'}=1,35.30=40,5,y=0,04mol\)
Gọi x,y là số mol của NO,N2O trong hh ta có hệ:
\(\begin{cases}30x+44y=0,04.40,5\\x+y=0,04\end{cases}\) \(\Rightarrow n_{NO}=x=0,01,n_{N2O}=0,03\)
Gọi a,b là số mol của Fe,R trong 3,3 gam hỗn hợp:
\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(R+nHCl\rightarrow RCl_n+\frac{n}{2H2}\)
\(\Rightarrow56a+Rb=3,3\) (*)
\(\Rightarrow a+\frac{bn}{2}=0,12\) (**)
Hòa tan X trong HNO3
Quá trình oxi hóa
Fe →Fe3+ +3e
R→ Rn+ +ne
Quá trình khử:
NO3- +4H+ +3e → NO +2H2O
0,04 ← 0,03 ←0,01
NO3- +8H+ +8e → N2O +2H2O
0,3 ← 0,24 ←0,03
Áp dụng bảo toàn electron ta có
3a+ nb =0,27 (3)
Từ 2,3 → a=0,03 ,nb=0,18 thay vào 1 ta có: R=9n → n=3,R=27 → là Al
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
nHNO3du =0,01.0,34=0,034 mol=nH+ dư
cho NaOH vào Z
H+ + OH- → H2O
0,034→0,034
Fe3+ + 3OH- → Fe(OH)3
0,03→0,09→0,03
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- →AlO2- + 2H2O
Vì Fe(OH)3 kết tủa hết → nAl(OH)3 =(4,77-3,21)/78=0,02 mol < nAl3+ =0,06 mol → có 2 trường hợp
TH1 : Al3+ dư → nNaOH =0,034 +0,09 +0,06 =0,184 mol → CM(NaOH)=0,184/0,4=0,46M
TH2: Al3+ hết → nNaOH =0,034 +0,09 +0,18 +0,04 =0,344 mol → CM(NaOH)=0,344/0,4=0,86M

Câu 18 : Mình lộn kqJamie Prisley
Pthh: BaCl2+K2CO3->BaCO3+2KCl
_______0,1_________________0,2 mol
bài ra ta có
VBaCl2=100ml=0,1l
CM BaCl2=1M
=>n BaCl2=0.1*1=0,1 mol
Chất tan sau pứng là KCl
Theo PTHH ta có
nKCl=2n BaCl2=0,2 mol
Theo bài ra ta có
V KCl=0.1+0.1=0.2 l
=> CM KCl=0,2/0,2=1M
Câu 1: B. Ba(HCO3)2, NaHCO3, Ca(HCO3)2.
Câu 2: D. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Câu 3: A. Na2CO3, MgCO3, Ca(HCO3)2, BaCO3.
Câu 4: A. Na2CO3, CaCO3.
Câu 5: D. K2CO3 và Na2SO4.
Câu 6: A. HCl và KHCO3.
Câu 7: B. 0,25 lít.
Câu 8: B. Nhỏ từ từ dung dịch H2SO4 vào ống nghiệm có sẵn một mẫu BaCO3.
Câu 9: A. CO2.
Câu 10: C. CO2.
Câu 11: B. 39,4 gam.
Câu 12: B. Dung dịch HCl.
Câu 13: A. AgCl, AgNO3, Na2CO3.
Câu 14: C. H2SO4.
Câu 15: B. NaHCO3, Ca(HCO3)2, Mg(HCO3)2, Ba(HCO3)2.
Câu 16: A. 142 gam.
Câu 17: A. 10,6 gam và 8,4 gam.
Câu 18: C. 0,2M.
Câu 19: C. 10,6 gam và 27,6 gam.

2 Lấy cùng một thể tích dd NaOH cho vào 2 cốc thủy tinh riêng biệt. Giả sử lúc đó mối cốc chứa a mol NaOH.
Sục CO2 dư vào một cốc, phản ứng tạo ra muối axit.
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
Theo pt (1,2) nNaHCO3 = nNaOH = a (mol)
* Lấy cốc đựng muối axit vừa thu được đổ từ từ vào cốc đựng dung dịch NaOH ban đầu. Ta thu được dung dịch Na2CO3 tinh khiết
NaHCO3 + NaOH → Na2CO3 + H2O
1.Kết tủa A là BaSO4, dung dịch B có thể là H2SO4 dư hoặc Ba(OH)2
TH1: Dung dịch B là H2SO4 dư
Dung dịch C là Al2(SO4)3 ; Kết tủa D là Al(OH)3
TH2: Dung dịch B là Ba(OH)2
Dung dịch C là: Ba(AlO2)2 ; Kết tủa D là BaCO3
các pthh
BaO + H2SO4 → BaSO4 + H2O
BaO + H2O → Ba(OH)2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4
Ba(OH)2 + 2H2O + 2Al → Ba(AlO2)2 + 3H2
Ba(AlO2)2 + Na2CO3 → BaCO3 + 2NaAlO2
Đáp án B.
K 2 CO 3 và Ba NO 3 2 → 2 KNO 3 + BaCO 3 ↓