Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D

Vì n B a C l 2 1 = 0,12 < n H 2 S O 4 1 = 0,2
Vậy H 2 S O 4 dư, B a C l 2 hết
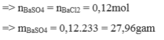

\(n_{BaCl2}=1.0,2=0,2\left(mol\right)\)
Pt : \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\)
\(n_{BaCl2}=n_{BaSO4}=0,2\left(mol\right)\)
\(\Rightarrow m_{kt}=m_{BaSO4}=0,2.233=46,6\left(g\right)\)

\(a,PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\\ \left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên H2SO4 dư
\(\Rightarrow n_{BaSO_4}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\\ b,n_{HCl}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,25\cdot36,5=9,125\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{9,125}{441,75}\cdot100\%\approx2,07\%\)

\(n_{Na_2SO_4}=\dfrac{100.28,4\%}{142}=0,2\left(mol\right)\)
PTHH: \(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
0,2------>0,2--------->0,2
`=>` \(\left\{{}\begin{matrix}C\%_{BaCl_2}=\dfrac{0,2.208}{200}.100\%=20,8\%\\m=m_{BaSO_4}=0,2.233=46,6\left(g\right)\end{matrix}\right.\)

Nhận xét: nAl(OH)3 = 0,05 < nAlCl3 → kết tủa chưa đạt tối đa.
TH1: kết tủa chưa bị hòa tan
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
0,025 ← 0,05
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
0,075 ← 0,05
→ nBa(OH)2 = 0,1 → V = 100 ml
TH2: kết tủa bị hòa tan một phần
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
0,025 ← 0,05
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
0,15 ← 0,1 → 0,1
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
0,025 ← 0,05
Dư: 0,05
→ nBa(OH)2 = 0,2 → V = 200 ml
Vậy có 2 giá trị của V là: 100 và 200



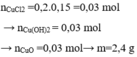

\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\n_{BaCl_2}=\dfrac{200.10,4\%}{208}=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: BaCl2 + H2SO4 \(\rightarrow\) BaSO4\(\downarrow\) + 2HCl
Ban đầu: 0,1 0,2
Pư: 0,1------->0,1
Sau pư: 0 0,1 0,1
=> \(m=m_{B\text{aS}O_4}=0,1.233=23,3\left(g\right)\)